Questões de Vestibular Comentadas sobre química
Foram encontradas 1.411 questões
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
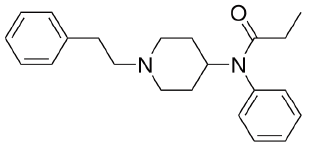
Tal fármaco possui
Com base nas informações, é correto afirmar que a artemisina apresenta
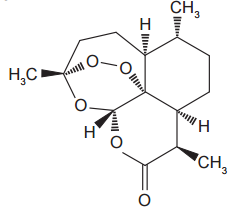
A seguir está representada a estrutura de uma substância orgânica de origem natural.
Nessa substância estão presentes as funções orgânicas
Os compostos I e II, representados a seguir, são hidrocarbonetos cíclicos.
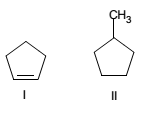
De acordo com as regras da União internacional de Química Pura e Aplicada (IUPAC), as nomenclaturas dos
compostos I e II são, respectivamente,
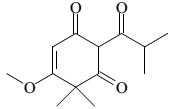
A seguir, estão representadas estruturas químicas de três substâncias orgânicas identificadas por I, II e III.
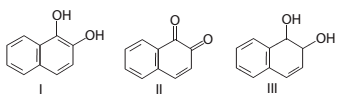
As funções orgânicas presentes em I, II e III, respectivamente,
são
O óleo de citronela é muito utilizado na produção de velas e repelentes. Na composição desse óleo, a substância representada a seguir está presente em grande quantidade, sendo, dentre outras, uma das responsáveis pela ação repelente do óleo.
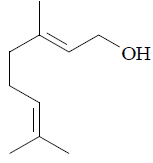
A cadeia carbônica dessa substância é classificada como aberta,
A ibugaína é extraída dessa raiz e tem fórmula estrutural
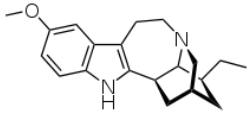
A partir da análise de sua estrutura, verifica-se que a ibogaína possui fórmula molecular

Admita que foram consumidos 252 g de HNO3 para a completa dissolução das medalhas. Nesse caso, a massa, de NaHSO3 , em gramas, necessária para a recuperação de todo o ouro corresponde a:
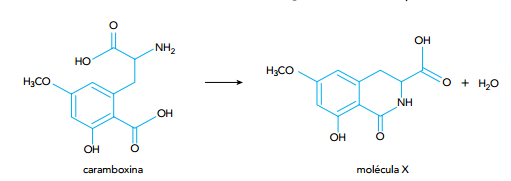
Nesse caso, dois grupamentos químicos presentes na caramboxina reagem formando um novo grupamento. A função orgânica desse novo grupamento químico é denominada:
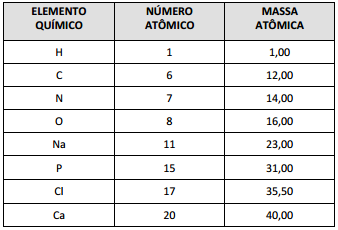
DADOS QUE PODEM SER USADOS NESTA PROVA
O fermento é responsável pelo aumento do volume de um bolo, que acontece assim: a temperatura alta faz com que o fermento libere gás carbônico; esse gás se expande e faz o bolo crescer. Quando adicionado na massa, o fermento sofre uma transformação química a partir da reação entre bicarbonato de sódio e fosfato dihidrogenado de cálcio:
NaHCO3 + Ca(H2 PO4)2 —–>
Assinale a opção que apresenta corretamente os
produtos ajustados dessa reação química.
DADOS QUE PODEM SER USADOS NESTA PROVA

Um carro estacionado na sombra durante um dia, com as janelas fechadas, pode conter de 400 a 800 mg de benzeno. Se está ao sol, o nível de benzeno subirá de 2000 a 4000 mg. A pessoa que entra no carro e mantém as janelas fechadas, inevitavelmente aspirará, em rápida sucessão, excessivas quantidades dessa toxina. O benzeno é uma toxina que afeta os rins e o fígado, e o que é pior, é extremamente difícil para o organismo expulsar esta substância tóxica. Por essa razão, os manuais de instruções de uso dos carros indicam que antes de ligar o ar condicionado, deve-se primeiramente abrir as janelas e deixá-las abertas por um tempo de dois minutos.
Com relação ao benzeno, assinale a afirmação
correta.
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

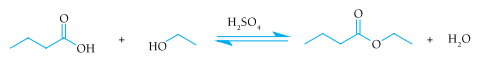
As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico:
Os aminoácidos que possuem um centro quiral apresentam duas formas enantioméricas. Observe, abaixo, a estrutura química de quatro aminoácidos.
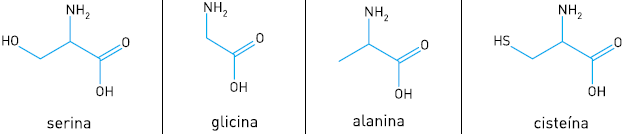
O único desses aminoácidos que não apresenta enantiômeros é: