Questões de Vestibular Comentadas sobre química
Foram encontradas 1.411 questões

 . Assim, no esquema
. Assim, no esquema








Note e adote: Volume molar nas condições de produção de biogás: 24 L/mol; energia liberada na combustão completa da gasolina: 4,5 x 104 kJ/L.
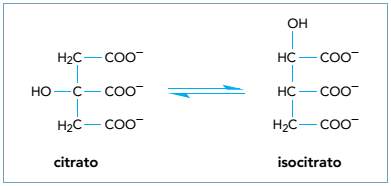
A isomeria plana que ocorre entre o citrato e o isocitrato é denominada de:
(www.agencia.fapesp.br. Adaptado.)
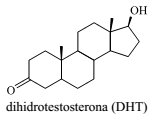
Sobre a DHT, cuja fórmula está representada, é correto afirmar que:
A sibutramina, cuja estrutura está representada, é um fármaco indicado para o tratamento da obesidade e seu uso deve estar associado a uma dieta e exercícios físicos.
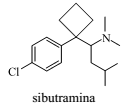
Com base nessa estrutura, pode-se afirmar que a sibutramina:
Na pele dos hipopótamos, encontra-se um tipo de protetor solar natural que contém os ácidos hipossudórico e nor-hipossudórico. O ácido hipossudórico possui ação protetora mais eficaz, devido à maior quantidade de um determinado grupamento presente em sua molécula, quando comparado com o ácido nor-hipossudórico, como se observa nas representações estruturais a seguir.
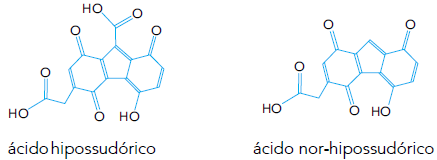
O grupamento responsável pelo efeito protetor mais eficaz é denominado:
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela abaixo:
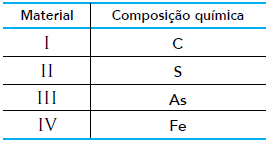
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte
número:
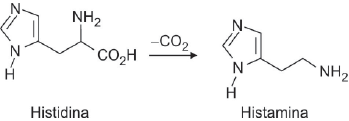
Nas estruturas de histidina e histamina, estão presentes as funções orgânicas:
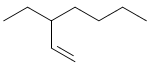
Segundo as regras da IUPAC, a nomenclatura do composto
representado acima é
A seguir está representada a estrutura do ácido fumárico.
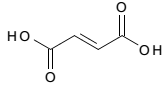
A respeito desse ácido, é correto afirmar que ele possui
Num processo de fissão nuclear, um nêutron colidiu com o núcleo de um isótopo do urânio levando à formação de dois núcleos menores e liberação de nêutrons que produziram reações em cadeia com liberação de grande quantidade de energia. Uma das possíveis reações nucleares nesse processo é representada por:
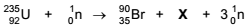
O produto X, formado na fissão nuclear indicada acima, é
um isótopo do elemento químico:
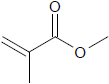
Essa substância possui fórmula molecular
A seguir está representada a estrutura da dihidrocapsaicina, uma substância comumente encontrada em pimentas e pimentões.
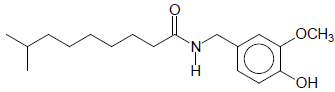
Na dihidrocapsaicina, está presente, entre outras, a função orgânica