Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Técnicos realizaram uma inspeção no local, obedecendo às normas de segurança que indicam o tempo máximo de contato com os vapores tóxicos do benzeno.
Observe a tabela:

Considerando as normas de segurança, e que a densidade do benzeno líquido é igual a 0,9 g.mL−1 , o tempo máximo, em horas, que os técnicos podem permanecer no interior do galpão, corresponde a:
Uma semelhança entre as estruturas atômicas desses elementos químicos que possibilita essa substituição é:
Os isótopos do cloro, de massas atômicas 35 e 37, estão presentes na natureza, respectivamente, nas porcentagens de:
A combustão completa dos hidrocarbonetos acarreta a formação de um óxido ácido que vem sendo considerado o principal responsável pelo efeito estufa.
A fórmula química desse óxido corresponde a:
Quando o peixe atinge a superfície, a massa de oxigênio molecular na bexiga natatória, em miligramas, é igual a:
Contaminante Concentração (mg/L) benzeno 0,39 metanal 0,40
Em análises químicas, o carbono orgânico total é uma grandeza que expressa a concentração de carbono de origem orgânica em uma amostra. Assim, com base nos dados da tabela, a concentração de carbono orgânico total na amostra de água examinada, em mg/L, é igual a:
(C6H10O) n + nH2O → n C6H12O6 glicogênio glicose
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
Técnicos realizaram uma inspeção no local, obedecendo às normas de segurança que indicam o tempo máximo de contato com os vapores tóxicos do benzeno. Observe a tabela:
tempo máximo de permanência (h) concentração de benzeno na atmosfera (mg.L-1 ) 2 4 4 3 6 2 8 1
Considerando as normas de segurança, e que a densidade do benzeno líquido é igual a 0,9 g.mL−1 , o tempo máximo, em horas, que os técnicos podem permanecer no interior do galpão, corresponde a:
Dissolução
Au (s) +3 HNO3 (aq) + 4 HCl (aq) → HAuCl4 (aq) + 3 H2 O (l) + 3 NO2 (g)
Recuperação
3 NaHSO3 (aq) + 2 HAuCl4 (aq) + 3 H2 O (l) → 3 NaHSO4 (aq) + 8 HCl (aq) + 2 Au (s)
Admita que foram consumidos 252 g de HNO3 para a completa dissolução das medalhas. Nesse caso, a massa, de NaHSO3 , em gramas, necessária para a recuperação de todo o ouro corresponde a:
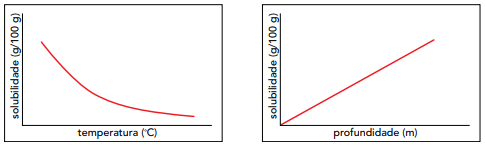
Um estudo realizado sob quatro diferentes condições experimentais, para avaliar a dissolução de oxigênio no plasma desses animais, apresentou os seguintes resultados:
Parâmetros Condições experimentais avaliados W X Y Z
temperatura baixa baixa alta alta
profundidade alta baixa baixa alta
O transporte de oxigênio dissolvido no plasma sanguíneo foi mais favorecido na condição experimental representada pela seguinte letra:
Equação de Clapeyron Equação de Boltzmann P × V = n × R × T P × V = N × k × T n – número de mols N – número de moléculas R – constante dos gases k – constante de Boltzmann
De acordo com essas equações, a razão R/K é aproximadamente igual a:
HCN (aq)⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo grau de ionização α constante de equilíbrio Ka potencial hidrogeniônico pH concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização. O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
Uma amostra de 4,99 g desse sal hidratado foi aquecida até que toda a água nela contida evaporou, obtendo-se uma massa de 3,19 g de sulfato de cobre II. O número de mols de água por mol de sulfato de cobre II na composição do sal hidratado equivale a:
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução: HCl, NaCl, NaOH e NaHCO3 .
Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
Em uma das etapas do ciclo de Krebs, ocorre uma reação química na qual o íon succinato é consumido. Observe a fórmula estrutural desse íon:
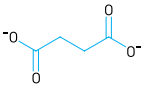
Na reação de consumo, o succinato perde dois átomos de hidrogênio, formando o íon fumarato.
Sabendo que o íon fumarato é um isômero geométrico trans, sua fórmula estrutural
corresponde a:
Suponha que, em alguns dos locais atingidos pela radiação, as pastilhas disponíveis continham, cada uma, 5 x 10−4mol de iodeto de potássio, sendo a dose prescrita por pessoa de 33,2 mg por dia. Em razão disso, cada pastilha teve de ser dissolvida em água, formando 1L de solução.
O volume da solução preparada que cada pessoa deve beber para ingerir a dose diária prescrita de iodeto de potássio corresponde, em mililitros, a:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq) ⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
Leia o texto para responder à questão.
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)

Leia o texto para responder à questão.
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)

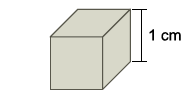
Deseja-se recobrir as faces desse cubo com uma camada uniforme de cobre de 1 × 10–2 cm de espessura. Para isso, o cubo pode ser utilizado como cátodo de uma cuba eletrolítica contendo íons Cu2+(aq). Admita que a eletrólise se realize sob corrente elétrica de 200 mA, que a constante de Faraday seja igual a 1 × 105 C/mol e que a densidade do cobre seja 9 g/cm3 . Assim, estima-se que o tempo de eletrólise necessário para que se deposite no cubo a camada de cobre desejada será próximo de