Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
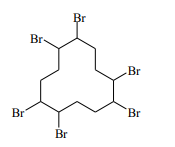
Nessa substância, está presente a função orgânica
O benzeno reage completamente com oxigênio, conforme indicado na equação:
2 C6 H6 (l) + 15 O2 (g) → 12 CO2 (g) + 6 H2O (g); ∆H° = -6.600 kJ
Um volume, em mL, de benzeno foi reagido em excesso de oxigênio produzindo -132 kJ de energia. Se a densidade do benzeno é 0,88 g mL-1 , o volume do hidrocarboneto mais próximo daquele que reagiu foi
Dado
M (C6
H6
) = 78,0 g mol-1
O hidróxido de cálcio, Ca(OH)2 , pode ser neutralizado com H2 SO4 , de acordo com a equação química balanceada representada a seguir:
H2 SO4 (aq) + Ca(OH)2 (aq) → CaSO4 (aq) + 2 H2 O(l)
A respeito das espécies químicas que participam dessa reação de neutralização, verifica-se que o
Dado M (CH3 CHOHCOOH) = 90,0 g mol-1
"O ouro, a prata e a platina são os metais preciosos mais populares do mundo. O mais valioso, entretanto, é o ródio, usado principalmente nos catalisadores automotivos para diminuir as emissões de gases tóxicos, na indústria eletrônica, em equipamentos óticos, etc. Na Rússia o ródio é um subproduto da mineração do níquel". (Adaptado de https://economia.uol.com.br/noticias/bbc/2018/08/17/porque-o-rodio-se-tornou-o-metal-precioso-mais-caro-domundo.htm, acessado em 05/08/2019).
A respeito do texto, assinale a alternativa correta.
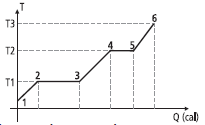
Considerando que, durante todo o processo, a substância recebeu calor, mantendo a pressão constante, analise as alternativas abaixo e marque a correta.
Assim como o diamante e os fulerenos, o grafeno é um alótropo do Carbono (Z = 6) tendo a espessura de apenas um átomo. Por apresentar alta resistência, leveza e ser excelente semicondutor, tem sido um dos materiais mais promissores empregados em nanotecnologia e inovação.
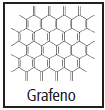
Sobre o grafeno e o átomo de carbono, analise os itens a seguir:
I) Todos os átomos de carbono do grafeno possuem hibridização sp2 e geometria trigonal plana, com orbitais “p” perpendiculares ao plano formado pelos anéis aromáticos.
II) A distribução eletrônica dos átomos de carbono no grafeno é 1s2 , 2s2 , 2p2 .
III) O átomo de carbono pode apresentar três tipos de hibridização diferentes ao formar ligações covalentes.
IV) Os átomos de carbono tetraédricos podem fazer quatro ligações iguais, usando orbitais não hibridizados.
Estão corretos apenas:
O triptofano é um aminoácido essencial que desempenha diversas funções no organismo humano, sendo usado na biossíntese de proteínas e como precursor bioquímico na síntese da serotonina.
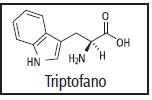
Sobre sua estrutura química, analise os seguintes itens:
I) É um composto que contém apenas um átomo de carbono quiral, com configuração absoluta (S).
II) É uma amina alifática secundária que atua como base de Lewis e pode ser protonada em pH muito ácido.
III) É um aminoácido que possue em sua estrutura um cicloalcano não aromático com duplas ligações alternadas.
IV) O grupo carboxila é responsável pela acidez da molécula e pode ser desprotonado em meio básico.
Estão corretos apenas:
“As armas químicas são vistas como cruéis e incomuns. Mesmo sendo consideradas menos eficazes do que os armamentos mais tradicionais, as armas químicas representam uma grande ameaça”.
(Adaptado de https://www.fatosdesconhecidos. com.br/7-terriveisarmas-quimicas-que-existem/, acessado em 05/08/2019)
As estruturas de alguns compostos utilizados em situação de Guerra são apresentados abaixo:
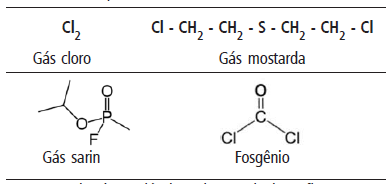
A respeito das moléculas acima, assinale a afirmação correta.
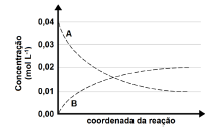
Com base nas informações, analise os itens I a III.
I) A reação balanceada entre as espécies citadas é 3A⇔2B. II) O valor da constante de equilíbrio da reação é 4x102 . III) O equilíbrio estabelecido é deslocado para os produtos ao se diminuir o volume do recipiente.
Está(ão) correto(s):
Assinale a alternativa que contém a ordem decrescente da temperatura de ebulição das seguintes espécies químicas:
H2; Ne; CO e NH3.
Dados: H: 1 g/mol; Ne: 20 g/mol; C: 12 g/mol; N: 14 g/mol; O: 16 g/mol.
Baseado nos conceitos químicos, analise as afirmações a seguir.
I O comprimento da ligação entre o enxofre e o oxigênio no SO3 é menor que a ligação entre enxofre e oxigênio no SO32- .
II O comprimento da ligação entre os átomos de nitrogênio no N2 é maior que a ligação entre os átomos de nitrogênios no N2H4.
III Na mesma concentração, temperatura e pressão o ácido acético é mais forte que o ácido tricloroacético.
Está(ão) correta(s) apenas:
Sob temperatura de 25ºC foram misturados 500mL de uma solução de hidróxido de sódio 0,1 mol/L com 500mL de uma solução de ácido clorídrico 0,05 mol/L. Assim, analise as afirmações a seguir. Dados: log5 = 0,7
I A mistura terá um pH = 12,4.
II Na mistura terá [OH- ] = 2,5.10-3 mol/L.
III Na mistura terá uma [Na+ ] = 0,05 mol/L.
IV Na mistura terá uma [Cl- ] = 0,05 mol/L.
Está(ão) correta(s) apenas:
Para determinar a porcentagem de prata em uma liga metálica, 0,500g dessa liga foi dissolvida em ácido, causando a dissolução da prata na forma de íons Ag+ . Essa dissolução foi diluída em água e adicionado um indicador apropriado para titulação com uma solução de [KSCN] = 0,1 mol/L.
Ag+(aq) + SCN-(aq) → AgSCN(s)
Nessa titulação foram necessários 40 mL da solução de KSCN. A porcentagem em massa de prata nessa liga é: Dados: Ag: 108g/mol.
A reação (não balanceada) dos íons permanganato com íons iodeto em meio alcalino pode ser representada por:
I-(aq) + MnO4-(aq) + H2O I2(aq) + MnO2(s) + OH-(aq)
Uma vez balanceada, a soma dos menores coeficientes estequiométricos inteiros dos reagentes é:
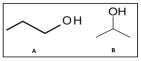
Assinale a alternativa que contém os respectivos compostos orgânicos formados.
Baseado nas informações fornecidas e nos conceitos químicos, analise os itens a seguir.
I Misturando-se 2 mL de uma solução de Codaten® com 5 gotas de KMnO4 (1,0 mol/L) observa-se a mudança da coloração de violeta para castanho.
II Misturando-se separadamente 2 mL de uma solução de Energil C® e 2 mL de uma solução de Tylenol® ,ambas com 5 gotas do regente de Jones, observa-se uma coloração verde em ambas reações.
III As fórmulas do óxido de manganês IV, sulfato de cromo III, cloreto férrico e bicarbonato de sódio são, respectivamente:
MnO2, Cr2(SO4)3, FeCl2 e NaHCO3.
IV Misturando-se 2 mL de uma solução de Aspirina® com 5 gotas de bicarbonato de sódio (1,0 mol/L) observa-se a liberação de um gás.
Assinale a alternativa correta.