Questões de Vestibular de Química - Representação das transformações químicas
Foram encontradas 203 questões
Na produção de sabão, uma amostra de 100 g de hidróxido de sódio reage com a estearina, de acordo com a reação não balanceada a seguir:
(C17H35COO)3C3 H5(s) + NaOH(aq) → C17H35COONa(s) + C3H5 (OH)3( l )
Considerando que, a partir de 100 g de hidróxido de
sódio, foram obtidos 512 g de estearato de sódio, o rendimento
deste procedimento é aproximadamente igual a
Um volume de 16.42 mL de uma solução de permanganato de potássio 0.1327 M é necessário para oxidar 20.00 mL de uma solução de FeSO4 em meio ácido.
Considere que a equação não balanceada representativa da reação é:
Fe2+ + MnO4 − + H+ → Mn2+ + Fe3+ + H2O
A concentração da solução do sal de ferro será
aproximadamente:
A metilona – um derivado das anfetaminas – produz efeitos semelhantes aos do ecstasy (MDMA), sendo, portanto, um estimulante gerador de euforia e de mais energia e capaz, também, de alterar a percepção sensorial.
Observe a fórmula estrutural da metilona, apresentada a seguir.
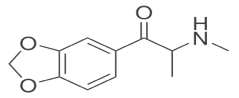
A metilona possui:
Dois elementos genéricos X e Y apresentam as seguintes distribuições eletrônicas por camadas: X(2, 8, 8, 1) e Y(2, 8, 18, 6). Considerando-se uma provável ligação química entre esses elementos (X e Y), afirma-se:
I O átomo X ganha 1 elétron e transforma-se em um cátion monovalente.
II A fórmula do composto formado é X2Y.
III A ligação que ocorre entre eles é do tipo iônica.
IV O átomo Y cede 2 elétrons e transforma-se em um ânion bivalente.
São corretas apenas as afirmações:
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa) 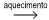 sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,
Dados de massas molares em g∙mol-1: sulfato de cobre (II) pentaidratado = 250; hidróxido de cálcio = 74.
Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
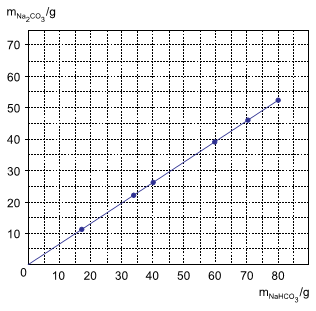
Os dados do gráfico permitem concluir que as massas de
carbonato de sódio e bicarbonato de sódio nessa reação
estão relacionadas pela equação 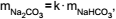 e
que o valor aproximado de k é
e
que o valor aproximado de k é
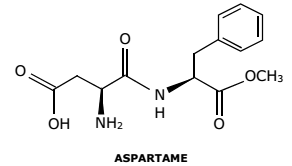
Considerando a equação de formação da glicose não balanceada C + H2 + O2 → C6H12O6 , atente às seguintes equações:
I. C + O2 → CO2 ΔH = −94,1 kcal
II. H2 + ½ O2 → H2O ΔH = −68,3 kcal
III. C6H12O6 + 6O2 → 6CO2 + 6 H2O ΔH = −673,0 kcal
A massa de glicose formada a partir da reação de 14,4 g de carbono e sua entalpia de formação em kcal/mol serão, respectivamente,
A hemoglobina é uma proteína de elevada massa molar, responsável pelo transporte de oxigênio na corrente sanguínea. Esse transporte pode ser representado pela equação química abaixo, em que HB corresponde à hemoglobina.
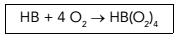
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
O cloreto de sódio, principal composto obtido no processo de evaporação da água do mar, apresenta a fórmula química NaCl.
Esse composto pertence à seguinte função química:
INSTRUÇÃO: Para responder à questão, analise o texto e a estrutura a seguir.
Uma das preocupações do Comitê Olímpico Internacional é combater o doping de atletas nas Olimpíadas. Para isso, uma série de análises é realizada rotineiramente com amostras de urina colhidas dos atletas. Nessas análises, uma das substâncias pesquisadas é o THG, que é um esteroide anabolizante. Os métodos de análise são extremamente sensíveis, sendo possível detectar THG em uma concentração tão baixa como 1 ppb (uma parte por bilhão). Isso significa uma concentração em que há um bilionésimo de grama de THG para cada grama de amostra.
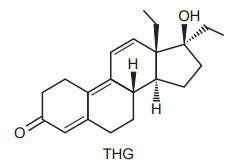
De acordo com as informações acima, assinale a
alternativa correta.
Note e adote: Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
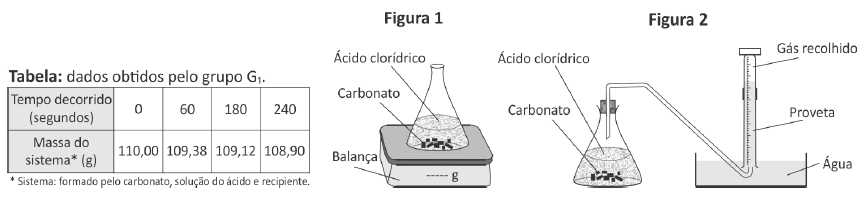
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
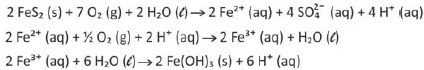
Considerando a equação química que representa a
transformação global desse processo, as lacunas da frase
“No intemperismo sofrido pela pirita, a razão entre as
quantidades de matéria do FeS2(s) e do O2(g) é __________,
e, durante o processo, o pH do solo __________” podem ser
corretamente preenchidas por
O mercúrio é um metal prateado que, em temperatura ambiente, é líquido e inodoro. Quando a temperatura é aumentada, transforma-se em vapor tóxico e corrosivo. Trata-se de produto perigoso à saúde quando inalado, ingerido ou em contato, causando irritação na pele, olhos e vias respiratórias. Uma forma de obtenção de mercúrio se dá por ustulação do sulfeto de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
Sabendo-se que o sulfeto de mercúrio II possui 70 % de pureza, a massa de mercúrio produzida pela ustulação de uma tonelada do composto é
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.


