Questões de Vestibular de Química - Representação das transformações químicas
Foram encontradas 889 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
 e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
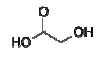
ClCH2CO2H + NaOH → HOCH2CO2H + NaCl
Desta forma, alguns milhões de quilogramas de ácido glicólico são produzidos anualmente.
Calcule a quantidade de ácido glicólico produzida a partir de 200 g de ácido cloroacético e 70,0 g de hidróxido de sódio. Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16; Na = 23; Cl = 35,5.
x Au(s) + y NO3− (aq) + w H+ (aq) + z Cl− (aq) → a AuCl4− (aq) + b H2O(l) + d NO(g)
Após balancear a equação acima com os menores números possíveis, correspondentes, a soma dos coeficientes estequiométricos será:
De acordo com os dados fornecidos sobre o Paraquat, determine a sua fórmula mínima e a sua fórmula molecular, respectivamente.