Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 888 questões
Considerando-se a Lei da Conservação da Massa e o processo envolvido, aponte a alternativa correta.
Cu2CO3(OH)2 + 8SiO2 + 2CaCO3 → 2CaCuSi4O10 + 3CO2 + H2O
Em um experimento, foram misturados 221 gramas de Cu2CO3(OH)2, 600 gramas de SiO2 e 1000 gramas de CaCO3.
Considerando as informações fornecidas e que a massa molar (g mol–1) de Cu2CO3(OH)2 é 221, a de SiO2(s) é 60, a de CaCO3 é 100 e a de CaCuSi4O10 é 376, qual será a massa de pigmento azul egípcio obtida, em gramas?
Na produção de aço, é crucial garantir que a matéria-prima utilizada (minério de ferro) contenha a quantidade correta de ferro. A presença de impurezas ou variações na concentração de ferro pode afetar significativamente as propriedades mecânicas do aço, como sua resistência e durabilidade. Para determinar o conteúdo de ferro na amostra do minério de ferro, é necessário dissolver o material em ácido sulfúrico (H2 SO4 ) para converter todo o ferro presente em íons Fe²⁺. O ferro, então, é titulado com uma solução de Ce4+ de concentração conhecida. As equações de semirreação de redução e a imagem a seguir servem para ilustrar esse procedimento de titulação.


Portanto, considere o contexto desse experimento para responder à seguinte questão: Qual dos seguintes processos ocorre durante a titulação representada na imagem?
A maioria dos aromas que sentimos cotidianamente é consequência da presença de pequenas moléculas orgânicas na composição de produtos do nosso dia a dia. O aroma das rosas, por exemplo, pode ser atribuído aos seguintes compostos como contribuintes principais.

Disponível em: https://www.compoundchem.com/2017/02/14/roses/. Acesso em: 30 jun. 2024 (adaptado).
Com base nas estruturas fornecidas, é correto afirmar que
DADOS QUE PODEM SER USADOS NESTA PROVA

No que diz respeito à pressão do gás, é correto afirmar que
Dado: massa molar do HCl = 36,5 g/mol.
H2PO3F(aq) + 2 NaOH(aq) → Na2PO3F(aq) + 2 H2O(l)
Adicionou-se uma solução de NaOH 0,14 mol L-1 ao ácido até ser obtido 0,28 mol de Na2PO3F. Qual foi o volume da solução de NaOH adicionado?

A partir desses dados, qual a massa, em miligramas, de AAS presente no comprimido?
DADOS QUE PODEM SER USADOS

DADOS QUE PODEM SER USADOS

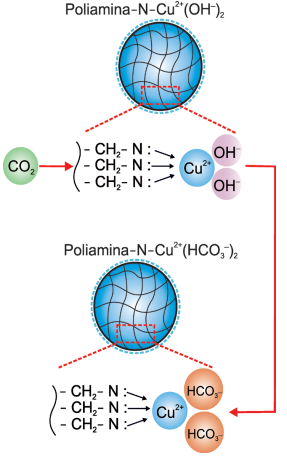
De acordo com os autores do estudo, 1 kg de poliamina contendo cobre é capaz de adsorver até 5 mols de CO2 , uma quantidade bem superior ao que se conhece até então. Com base nessas informações, pode-se concluir que a porcentagem em massa de cobre no sólido é cerca de
Dados:
i) ingestão total de energia diária para adultos: 8400 kJ (recomendação da OMS).
ii) energia por grama de açúcar: 16,5 kJ.
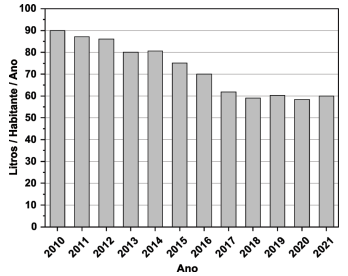
De acordo com as informações do gráfico e do texto 1, pode-se afirmar que a média de consumo diário de açúcar, por habitante, para cada ano, devido somente à ingestão de refrigerante,
CaC2 (s) + 2 H2 O (l) → Ca(OH)2 (aq) + C2 H2 (g)
O nome do composto orgânico obtido nessa reação é:
CH4(g) + 3 Cl2(g) → CHCl3(l) + 3 HCl(g)
A quantidade de cloro, em gramas, necessária para produzir 1,5 mol de clorofórmio é
PO4 3− + 12MoO4 2− + 27H+ → H3PMo12O40 + 12H2O
Nesse teste, a quantidade de matéria de MoO4 2− necessária para uma amostra de 10 mL contendo 2 mg L−1 de H3PO4 (98 g mol−1) é mais próxima de:
Dados: 1 mg = 10−3 g; 1 mL = 10−3 L

BRANDÃO, H. N., DAVID, J. P., COUTO, R. D., NASCIMENTO, J. A. P., DAVID, J. M. Quím. Nova, Vol. 33 (6), 1359-1369, 2010.
Tendo como base um caso hipotético para o Paclitaxel que envolva duas etapas reacionais, conforme a ilustração dada, e partindo-se de 1 mol de reagentes na etapa reacional 1, ao final de todo o processo de síntese do Paclitaxel, quantos gramas desse composto seriam sintetizados?