Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 879 questões
Considere a equação da reação de combustão incompleta do gás butano:

A massa do gás monóxido de carbono (massa molar = 28 g/mol) formada quando 522 kg de gás butano (massa molar = 58 g/mol) sofrem combustão incompleta, numa reação com rendimento total, é de
Considerando que um termômetro possua cerca de 4,0 g de mercúrio, qual o número de átomos presentes no instrumento?
Dados: Massa atômica do Hg = 200 g.mol-1 ; número de Avogadro = 6,0 x 1023
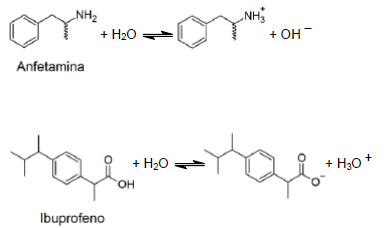
Com base nestas informações, indique qual fármaco será absorvido de forma mais eficiente pelo estômago e qual a fórmula molecular de sua estrutura não-iônica.
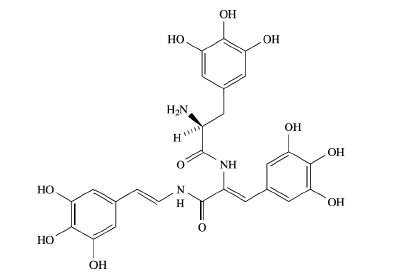
Acerca da estrutura do Tunicromo-B1, são realizadas algumas afirmações:
1) Em sua estrutura, são encontrados dois carbonos sp3.
2) A fórmula molecular do Tunicromo-B1 é C26H26O11N3.
3) São encontradas duas aminas secundárias e uma amina primária.
Está(ão) correta(s) a(s) afirmativa(s):
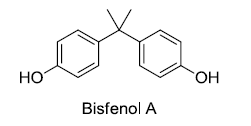
Acerca do bisfenol A, foram feitas algumas afirmações:
1) o bisfenol A é classificado como um composto aromático.
2) O bisfenol A apresenta apenas um carbono com hibridização sp3.
3) A fórmula molecular do bisfenol A é C15H16O2.
Está(ão) correta(s) a(s) afirmativa(s):
Dados: Massas molares em g.mol-1 : H = 1; C = 12; O = 16.


Selênio - Assim como a vitamina E, esse mineral possui grande capacidade antioxidante, ou seja, neutraliza a ação dos radicais livres (formados devido à ação dos raios solares, poluição, fumaça de cigarro, entre outros) no nosso corpo, retardando o processo de envelhecimento e evitando o desencadeamento de algumas formas de câncer. Castanha do Pará, alimentos marinhos, fígado, carne e aves são os alimentos mais ricos em selênio.
Disponível em:<http://www.vyaestelarnoticias.com.br/post/4688/alim> . Acesso em: 20 nov. 2018.
Comparando-se esses dois elementos, verificamos que o selênio, ao combinar, tende a adquirir carga negativa, enquanto o zinco tende a adquirir carga positiva.
Qual a fórmula do composto formado entre zinco e selênio.
Considerando o composto orgânico C5H10O, analise os seguintes itens:
I.butanoato de metila;
II.pentan-2-ona;
III.ácido pentanóico;
IV.pentanal.
São compostos que podem ser escritos usando a fórmula química acima apresentada somente os que constam nos itens
Dados: MM(Na2 CO3 ) = 106g/mol
Na2 CO3 + HCl⬄ NaCl + H2 CO3
