Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 873 questões

Segundo o site saúde.gov.br, diabetes é uma doença causada pela produção insuficiente ou má absorção de insulina, hormônio que regula a glicose no sangue e garante energia para o organismo. Para evitar que as células parem de funcionar, o organismo passa a usar os estoques de gordura para gerar energia. Só que nesse processo em que o corpo usa a gordura como energia, formam-se as cetonas. A equação química para a última etapa deste processo é a seguinte:
H3CCOCH2CO2H → H3CCOCH3 + CO2
A quantidade de acetona, produzida, em valores aproximados, que pode ser produzida a partir de 125 mg do ácido acetoacético, será:
Dados: massa molar (g/mol) C = 12; O = 16; Constante de Avogadro = 6.10 23 mol–1 C + O2 → CO2
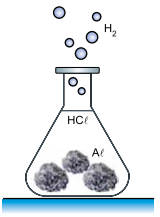
Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
A equação que representa essa reação é:
Aℓ (s) + 3HCl (aq) → AℓCℓ3 (aq) + 3/2H2 (g)
Considere que o hidrogênio seja um gás ideal, que a massa molar do alumínio seja 27 g/mol e que 1 L = 10–3 m3 . Adote para a constante universal do gases o valor R = 8 J/(mol · K). Supondo que todo o gás hidrogênio produzido nessa reação seja armazenado a uma temperatura constante de 27 ºC em um recipiente rígido de volume 10 L, a quantidade de hidrogênio produzida nessas condições ficaria submetida a uma pressão de
DADOS QUE PODEM SER USADOS NESTA QUESTÃO

DADOS QUE PODEM SER USADOS NESTA QUESTÃO

4Fe(s) + 4NaCℓO3(s) → 2Fe2O3(s) + 4NaCℓ(s) + 3O2(g) + calor.
A proporção adequada entre as massas dos dois reagentes para que a reação ocorra sem sobra de nenhum deles é
Duzentos gramas de carbonato de cálcio reagem com 96g de dióxido de enxofre produzindo sulfito de cálcio e dióxido de carbono. Assinale a alternativa que contém, respectivamente, a massa de sulfito de cálcio e o volume de dióxido de carbono, produzidos (nas CNTP) nessa reação.
Dados: Ca: 40 g/mol; S; 32 g/mol; O: 16 g/mol; C: 12 g/mol.
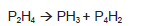
A equação química, não balanceada, representa um processo de obtenção da fosfina, PH3, um gás incolor cujo odor é semelhante ao de peixes em decomposição.
Balanceando-se essa equação, com os menores coeficientes inteiros e considerando-se os conhecimentos sobre ligações químicas, fórmulas químicas, reações químicas, é correto afirmar:
CARGUEIRO COM 2400 TONELADAS DE ÁCIDO
SULFÚRICO VIROU NO RIO RENO
Um cargueiro com 2400 toneladas de ácido sulfúrico virou-se [...] no rio Reno, ao passar pela Alemanha. Dois membros da tripulação estão dados como desaparecidos. [...]
Disponível em: http://www.publico.pt/ciencia/noticia/cargueiro-com-2400-- toneladas-de-acido-sulfurico-virouse-no-rio-reno-1475034. Acesso em: 15 de agosto de 2015.
[Dados: M(H2SO4) = 98 g/mol; M[Ca(OH)2] = 74 g/mol; N.A. = 6,0 ˑ 1023]
Supondo que toda a massa fornecida seja só de ácido sulfúrico, pode-se inferir que
Considere a reação abaixo (não balanceada):
NH3 + O2 ➔ NO + H2O
O número de moléculas de NO formadas na reação da amônia (NH3) com 2,0 .1021 moléculas de oxigênio será:
Considere a equação química (não balanceada) para a combustão do etanol:
C2H6O(l) + O2(g) ➜ CO2(g) + H2O(l)
Dados: Entalpia de formação de C2H6O(l) = – 66 kcal/mol
Entalpia de formação de CO2(g) = – 94 kcal/mol
Entalpia de formação de H2O(l) = – 68 kcal/mol
A entalpia de combustão em kcal/mol será:
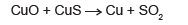
Com base nos conhecimentos sobre cálculos estequiométricos, a massa de cobre obtida quando 159 kg de óxido de cobre reagem completamente com sulfeto de cobre é, aproximadamente,
Fe2+ (aq) + HCO-3 (aq) + O2 (aq) → Fe2O3(s) + CO2(g) + H2O(l)
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom, quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
TEXTO 01
E se fosse possível captar CO2 da atmosfera para criar combustível?
Uma das principais preocupações na atualidade é a questão ambiental; todos sabem que os diversos poluentes emitidos diariamente são prejudiciais para nosso planeta, e nem sempre há alternativas acessíveis para controlá-los. Mas e se soluções simples pudessem ser usadas - por exemplo, capturar gás carbônico diretamente da atmosfera e transformá-lo em combustível?
(Disponível em:< https://www.tecmundo.com.br/ciencia/131145-fosse-possivel-captar-co2-atmosfera-criar- combustivel.htm. >Acesso em:10/08/2018.)
Após o balanceamento da equação iônica, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Tabagismo passivo é a inalação da fumaça de derivados do tabaco, tais como cigarro, charuto, cigarrilhas, cachimbo, narguilé e outros produtores de fumaça, por indivíduos não fumantes, que convivem com fumantes em ambientes fechados, respirando as mesmas substâncias tóxicas que o fumante inala.
A fumaça do cigarro é uma mistura de aproximadamente 4.720 substâncias tóxicas diferentes que se constituem de duas fases fundamentais: a particulada e a gasosa. A fase gasosa é composta, entre outros, por monóxido de carbono, amônia, cetonas, formaldeído, acetaldeído, acroleína. A fase particulada contém nicotina e alcatrão. A nicotina é considerada pela OMS uma droga psicoativa que causa dependência. A nicotina age no sistema nervoso central, como a cocaína, com uma diferença: chega em torno de 7 a 19 segundos ao cérebro. Por isso, o tabagismo é classificado como doença e está inserido no Código Internacional de Doenças (CID-10) no grupo de transtornos mentais e de comportamento devido ao uso de substância psicoativa. Em 2011, houve um grande avanço que tem contribuído para que não haja mais a poluição tabagística ambiental nos recintos fechados. Houve a aprovação da Lei nº 12.546, de 14 de dezembro, que proíbe o fumo em local fechado em todo País. (TABAGISMO, 2019).
Para que o airbag de um carro possa inflar, pode ser utilizada a decomposição da azida de sódio, de acordo com a equação química não balanceada. Suponha que um airbag utilize 65 gramas de azida de sódio no processo de inflagem.
NaN3 (s) → Na (s) + N2 (g)
Considere os dados:
Massas molares: Na = 23 g/mol; N = 14 g/mol
Volume molar: 22,4 L
Nessas condições, quantos litros do gás serão formados nesse processo?
Fe2O3 + C →Fe + CO
(Dados: Massa molar do Fe2O3 = 160 g/mol; Massa molar do Fe = 56 g/mol) Quantos quilogramas de hematita são necessários para produzir 560 kg de Fe?