Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 873 questões
Em maio de 2003, começaram a surgir as primeiras mortes relacionadas ao uso do contraste radiológico Celobar, comercializado pelo laboratório Enila. Pelo menos 21 pessoas podem ter morrido em decorrência da ingestão de Celobar (suspensão aquosa de sulfato de bário preparada em solução de sulfato de potássio) em todo o país. Depois das primeiras mortes relacionadas ao medicamento, a Anvisa (Agência Nacional de Vigilância Sanitária) interditou o laboratório Enila, que teve a falência decretada e continua fechado. O Celobar é utilizado para radiografar órgãos transparentes aos raios-X e seu princípio ativo é o sulfato de bário, que é um agente radiopaco que bloqueia os raios-X. Áreas do corpo em que o sal se localiza aparecerão brancas na radiografia. Em junho do mesmo ano, a Anvisa verificou que o referido laboratório havia comprado 600 kg de carbonato de bário - usado na formulação de raticidas. A indústria informou que a substância foi usada para sintetizar o sulfato de bário, matéria-prima do Celobar. Embora o laboratório Enila tenha informado que descartou todo carbonato de bário, o laudo da Fundação Oswaldo Cruz relatou que foi detectada grande quantidade de carbonato no lote (14%).
(Fonte: texto adaptado do site: http://sites.ffclrp.usp.br/ceiq/p_olimpiadas_iii_situacao.htm)
As fórmulas dos três compostos citados, na ordem em que aparecem no texto, são:
Zn + 2Ag+ -> Zn+2 + 2Ag
Sobre esta reação marque a alternativa que apresenta corretamente a massa de prata metálica produzida a partir do consumo de 127 g de zinco metálico.
Dado: Zn – 65,5; Ag -108.
O incêndio na boate Kiss, em Santa Maria (RS), ocorrido no início deste ano [2013], trouxe à tona uma série de questões sobre a segurança dos estabelecimentos e também sobre o atendimento a vítimas de grandes incêndios. Uma delas é por que foi preciso trazer dos Estados Unidos uma substância tão simples – uma vitamina B injetável – para atender os pacientes que, segundo exames, foram intoxicados com cianeto?

O gás cianídrico liberado na queima da espuma, utilizada para melhorar a acústica da casa noturna, intoxicou a maior parte das vítimas, segundo perícia.
“É descaso e ignorância”, resume o toxicologista Anthony Wong, diretor do Ceatox (Centro de Assistência Toxicológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo). Segundo ele, é inadmissível que o país não tenha a substância e que seu uso não seja difundido entre médicos e socorristas, como acontece em outras partes do mundo.
A hidroxocobalamina, que faz parte do complexo B, é usada em altas concentrações como antídoto para o cianeto. O gás, o mesmo que já foi usado no extermínio de judeus nos campos de concentração nazistas, é subproduto da queima de diversos componentes usados na indústria, como o plástico, o acrílico e a espuma de poliuretano. Segundo os peritos que investigam o incêndio em Santa Maria, essa última foi usada no isolamento acústico da boate.
Capaz de matar em poucos minutos, o cianeto bloqueia a cadeia respiratória das células, impedindo que o oxigênio chegue aos órgãos e tecidos. Quando usada logo após a exposição, a hidroxocobalamina salva vidas. “O efeito é tão rápido que parece até milagroso”, conta Wong. Mas isso não é algo que os médicos aprendem na escola: “São poucas as faculdades que oferecem curso de toxicologia e, nas que tem, a matéria é opcional”.
(noticias.uol.com.br. Adaptado.)
Informações adicionais:
• O gás cianídrico é o cianeto de hidrogênio (HCN) no estado gasoso.
• A fórmula estrutural da hidroxocobalamina é:

• A massa molar da hidroxocobalamina é aproximadamente igual
a 1,3 × 10³g/mol.
O sal iodado é aquele onde foi adicionado iodo, ou na forma de IODETO(iodetado), normalmente iodeto de potássio, ou na forma de IODATO(iodatado), normalmente iodato de potássio.

O iodo serve para prevenir distúrbios causados pela supressão deste elemento de nossa alimentação, os chamados DDIs.
DDIs (Distúrbios por Deficiência de Iodo) são problemas de saúde, tais como: o bócio, abortos prematuros, retardos mentais, etc. Para consumo humano, é considerada adequada, para um adulto, a ingestão de 0,15 mg de iodo por dia.
Assinale a opção que contém a fórmula do iodeto de potássio e do iodato de potássio, respectivamente.
A aspirina, ou ÁCIDO ACETIL SALISILICO –AAS, é, talvez, o analgésico mais utilizado em todo o mundo.Dentre as opções abaixo, que fórmula representa este importante fármaco?

Antigamente,o lança-perfume era a coqueluche dos salões -até mesmo as crianças ganhavam tubinhos para se divertirem nos bailes. Hoje em dia,é considerado entorpecente pela vigilância sanitária, e seu uso no Brasil é crime. Com fabricação proibida no Brasil, ele aparece por ocasião do carnaval, contrabandeado de outros países sul-americanos, como Argentina , Paraguai , Uruguai, países onde seu consumo não é considerado crime.Dos componentes do lança perfume, os mais comuns são o éter etílico e o clorofórmio (triclorometano). Escolha a opção abaixo que contém as fórmulas destas duas substâncias.

Fonte: http://g1.globo.com
O esquema abaixo mostra a produção de álcool etílico a partir da cana de açúcar.
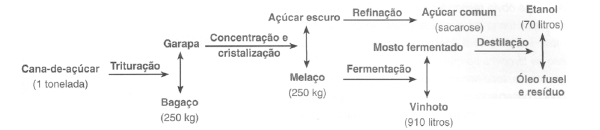
A partir dos dados informados, é possível concluir que, no período de 2011/2012, a quantidade de cana de açúcar usada para produzir o etanol será a seguinte:
MnO4- + Fe2+ + H+ → Mn2+ + Fe3+ + H2O
A soma dos coeficientes apenas no lado dos produtos, após o balanceamento, é
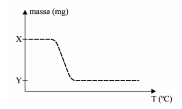
Se a diferença entre as massas X e Y no gráfico for 576 mg, o valor de Y e a porcentagem de perda da massa da reação de decomposição térmica do oxalato de magnésio são, respectivamente,

Bicarbonato de sódio é uma substância de múltiplas
utilidades, entre elas: é um antiácido; é usado por dentistas para limpeza dos dentes e por cozinheiros para acelerar a cocção de vários alimentos.
Sua fórmula é NaHCO3
Um estudante, que gosta de fazer graça com os outros,foi a uma farmácia e pediu 1 mol de bicarbonato de sódio.
O farmacêutico, que sabia bastante química (obviamente), informou ao estudante que tinha uma embalagem de 80 gramas e que esta quantidade teria,aproximadamente, 1 mol de bicarbonato de sódio.
Na verdade, podemos afirmar que
2 NaOH(aq) + Cl2(g) → NaClO(aq) + NaCl(aq) + H2O(l)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:
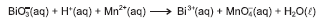
No balanceamento das equações de oxirredução, o fundamental é identificar o número de elétrons recebidos e cedidos, o número total de átomos de cada elemento químico no primeiro e segundo membros da equação química, além do total de carga elétrica em cada um de seus membros. Assim, com base nessas considerações, e a partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
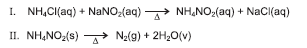
As bolinhas de tênis são feitas basicamente de borracha. Na primeira etapa de fabricação, a borracha é prensada em moldes de ferro e ganha forma de uma concha. Antes de as duas metades da bolinha serem coladas, coloca-se, no interior de uma delas, nitrito de amônia, que é obtido de acordo com a equação química I. Na etapa seguinte, as duas conchas são unidas por cola especial e, em seguida, prensadas a 200° C. Com o aquecimento, durante o processo de colagem, o nitrito de amônia se decompõe, de acordo com a equação química II, em nitrogênio, que exerce pressão no interior da bolinha. Admitindo-se que o volume da bolinha de tênis, a 25° C, é 140,0mL, que o volume de água produzido no seu interior é desprezível, é correto, a partir das informações do texto e das equações químicas I e II , afirmar:
Assim, considerando-se 100,0g de uma amostra de gases ideais, que contém 64% de SO2, e 36% de He, em massa a 27°C, a 1,0atm, no interior de um recipiente, é correto afirmar:
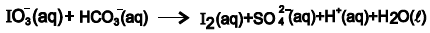
O iodato de sódio, NaIO3 , é utilizado como aditivo de sal de cozinha, NaCl, com objetivo de prevenir o bócio, uma doença provocada pela deficiência de iodo na alimentação. A equação química não balanceada representa a reação do íon iodato com o íon hidrogeno-sulfito, na determinação de iodo, I2 .
A partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
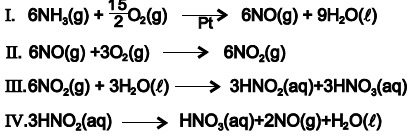
Com base nessas informações e de acordo com as equações químicas que representam o processo de fabricação do ácido nítrico, é correto afirmar:

Assim, considerando-se essas informações e os dados de decomposição de um determinado óxido de nitrogênio, NOx, relacionados na tabela, é correto afirmar:
C6H12O6 + ....... O2 → ....... CO2 + ...... H2O
Uma equação química deve representar a conservação dos átomos, portanto, essa equação estará correta se os coeficientes que estão faltando nas lacunas forem preenchidos, respectivamente, por:


