Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões
Al + H2SO4 ⇌ Al2(SO4)3 + H2
Um analista utilizou uma quantidade suficiente de H2SO4 para reagir com 5,4g do metal e obteve 5,71 litros do gás nas CNTP. Nesse processo, o analista obteve um rendimento aproximado de: Dados: Al = 27
2KI(aq) + Pb(NO3)2(aq) ↠ PbI2(s) + 2 KNO3(aq)
O iodeto de chumbo II produzido tem massa, aproximadamente, igual a:
CS2(l) + 3O2(g) ↠ CO2(g) + 2SO2(g)
Al + H2SO4 ↠ Al2(SO4)3 + H2
Um analista utilizou uma quantidade suficiente de H‚SO„ para reagir com 5,4g do metal e obteve 5,71 litros do gás nas CNTP. Nesse processo, o analista obteve um rendimento aproximado de: Dados: Al = 27
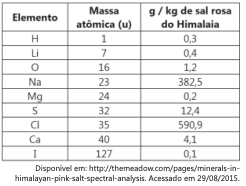
Mesmo que o sal rosa do Himalaia ofereça mais benefícios à saúde, a substituição do sal refinado por ele não contribui significativamente para a diminuição da ingestão do elemento causador da hipertensão, porque, para cada quilograma de sal refinado substituído por sal rosa do himalaia, a massa de sódio seria, aproximadamente:
“A forma como o lança-perfume “turbinado” vem sendo consumido, jogado diretamente na boca – e não inalado, como o produto tradicional – pode causar a morte em poucos segundos, alertam médicos especialistas em dependência química...” (Diego Zanchetta, em O Estado de São Paulo, abril de 2015. Disponível em: http://sao-paulo.estadao.com.br/noticias/geral,lanca-perfumeturbinado-e-vendido-livremente-na-frente-de-baladas-em-sao-paulo,1672343. Acessado em 23/08/2015).
O lança perfume é um mistura de solventes inalantes prejudiciais à saúde. Sua formulação mais recente, chamada de “turbinada” pelos trafi cantes, contém haletos orgânicos voláteis de uso industrial. Estes novos componentes são utilizados, por exemplo, na remoção de adesivos e como anti-respingo de solda e já provocaram a morte de vários usuários este ano. A fórmula de um composto utilizado na fabricação do lança-perfume “turbinado” é apresentada em:
C12H22O11(s) + O2(g) ⟶ CO2(g) + H2O(l) + energia
Nas condições normais de temperatura e pressão, o volume de CO2 produzido, como resultado da queima de 6,84 g de sacarose, é aproximadamente:

Um airbag é uma bolsa que infla rapidamente e que, num acidente de carro, ajuda a prevenir lesões graves, como mostra a figura ao lado. Quando se produz a desaceleração repentina do carro, é conectado automaticamente um interruptor, que inicia uma reação química, liberando o gás nitrogênio em quantidade suficiente, conforme a equação a seguir:
6 NaN3(l) + Fe2O3(s) 3 Na2O(s) + 2 Fe(s) + 9 N2(g)
Considere que o volume de um mol de gás, nas CNTP, corresponda a 22,4 litros. Nessas condições, de acordo com a equação química, quando reagem 3 moles de NaN3, o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
( ) O potencial padrão de redução do alumínio (E° = −1,66V) mostra que ele é facilmente oxidado. ( ) A resistência do alumínio à corrosão deve-se à formação de uma camada fina, dura e transparente de Al2O3 que adere à superfície do metal. ( ) A quantidade de matéria de alumínio necessária para se obter 204g de Al2O3 é 2,5 mols. ( ) O átomo de alumínio possui número atômico 13 e massa 26,98u.
Assinale a seqüência correta.
Considere: • detanol = 0,8g ⋅ cm−3 • N = 6,00 ×1023
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

I - 2 NaHCO3
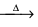 X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y
X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y Sobre esse processo, assinale a afirmativa correta.
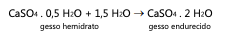
O conhecimento do processo químico de endurecimento do gesso permite avaliar possíveis alterações em sua massa. De fato, a equação química apresentada permite constatar que, após seu preparo, aplicação e endurecimento, o gesso apresenta:
Dados: massas moleculares (g/mol): H = 1, O = 16, S = 32, Ca = 40.
Al2(SO4)3 + Ca(OH)2 → Al(OH)3 + CaSO4
Os coeficientes estequiométricos desta reação são, respectivamente:
a Cd(NO3)2(aq) + b Na2S(aq) → x CdS(s) + y NaNO3(aq)
Após o balanceamento, a soma dos valores dos coeficientes estequiométricos a, b, x e y é: