Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 888 questões
HB + 4 O2 → HB(O2) 4
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
Na2Cr2O7 + xSO2 + H2O → yCr(OH)SO4 + Na2 SO4
Observe que existem duas incógnitas x e y que precisam ser determinadas para que a equação esteja “balanceada”, pois segundo a Lei de Lavoisier, “a soma das massas das substâncias reagentes é igual à soma das massas dos produtos da reação”. Logo, um sistema de equações pode ser utilizado para determinar tais valores, a saber:
Para o enxofre (S) temos a equação x = y + 1 e para o oxigênio (O) a equação 7 + 2x + 1 = 5y + 4.
Depois de balanceada com os menores coeficientes inteiros possíveis, ela apresenta:
KMnO4 + H2O → MnO2 + O2 + KOH
A soma dos menores coeficientes estequiométricos inteiros da equação, quando balanceada, é:
A história de contaminações por metais (rejeitos) das águas dos rios em Minas Gerais é antiga. Segundo informações de pesquisa da Unicamp, há 15 anos, o arsênio no solo e na água utilizada por moradores do Quadrilátero Ferrífero estaria relacionado à intensa mineração de ouro, explorada nos últimos 300 anos.
O arsênio está entre os metais mais nocivos à saúde humana. Quantidades elevadas (acima de 10-5 gramas por litro de água potável) podem provocar vários tipos de cânceres, além de abalos ao sistema nervoso, malformação neurológica e abortos.
(Fonte: Isabel Gardenal, Jornal da Unicamp, novembro de 2002.)
Sobre o arsênio e as informações apresentadas são feitas algumas afirmações. Assinale a correta:
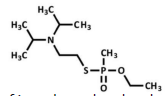
Pode-se afirmar que a fórmula molecular do agente VX é:
Dados: massa atômica H=1, C=12, O=16, Na=23
O biodiesel substitui total ou parcialmente o óleo diesel de petróleo em motores automotivos. O seu consumo contribui para a redução da poluição atmosférica, já que o biodiesel não contém enxofre em sua composição, além de gerar alternativas de empregos em áreas geográficas menos propícias para outras atividades econômicas. Tal combustível é obtido a partir da reação química entre óleos vegetais, como demonstrada na fórmula abaixo, ou gorduras, com um álcool, na presença de um catalisador, produzindo um novo éster (biodiesel) e a glicerina (C3H8O3). Admitindo uma reação entre 319 gramas de óleo de soja (massa molar 638g/mol) e metanol em quantidade suficiente, a massa formada de glicerina (massa molar 92 g/mol), numa reação com 50% de rendimento, é de
C39H74O6 + 3 CH3OH ↔ C3H8O3 + 3 C13H26O2
Sem dúvidas, o maior crescimento do feto ocorre durante o último trimestre de gestação; seu peso quase duplica durante os últimos 2 meses de gestação. Comumente, a mãe não absorve proteínas, cálcio, fosfatos e ferro suficientes pela dieta, durante os últimos meses de gestação para suprir essas necessidades extras do feto. Entretanto, antecipando essas necessidades extras, o corpo da mãe já armazenou essas substâncias – parte na placenta, mas a maioria nos depósitos normais da mulher. Se os elementos nutricionais apropriados não estiverem presentes na dieta da gestante, pode ocorrer uma série de deficiências maternas, especialmente de cálcio, fosfatos, ferro e vitaminas. Por exemplo, o feto precisa de cerca de 375 miligramas de fero para formar seu sangue, e a mãe precisa de outros 600 miligramas para formar seu próprio sangue extra. A reserva normal de ferro não ligado à hemoglobina na mulher, no início da gravidez, geralmente fica em torno de 100 miligramas e quase nunca acima de 700 miligramas. Por isso, sem ferro suficiente na dieta, a gestante muitas vezes desenvolve anemia hipocrômica.
JOHN E. HALL. Tratado de fisiologia médica. 12º ed Rio de Janeiro: Elsevier, 2011.
Na profilaxia e tratamento da anemia hipocrômica, normalmente são utilizados medicamentos à base de Ferro. Num dos mais comuns, o ferro apresenta-se na forma de “ferro aminoácido quelato”, fórmula química C4H8N2O4Fe. Quantos milimols de ferro ao dia um paciente que utilize diariamente a posologia de 265mg do medicamento ingere? (Dados: C = 12,0 g/mol; H = 1,0 g/mol; N = 14,0 g/mol; O = 16,0 g/mol; Fe = 53,0 g/mol)
Da forma semelhante a outros óxidos, o SO2 reage com a água formando o ácido sulfuroso: SO2 (g) + H2O (l) → H2SO3 (aq) H2SO3 (aq) → H+ (aq) + HSO3- (aq)
O SO2 pode ainda sofrer oxidação na atmosfera e formar o trióxido de enxofre (SO3), o qual, por sua vez, em contato com a água da chuva, formará o ácido sulfúrico (H2SO4), que é um ácido forte. SO2 (g) + ½ O2 (g) → SO3 (g) SO3 (g) + H2O (l) → H2SO4 (aq) H2SO4 (aq) → 2H+ (aq) + SO4 2- (aq)
Assumindo que a fórmula química do carvão é C135H96O9NS e que uma usina termelétrica movida a carvão queima cerca de 2,74 x 106 kg de carvão por dia, a quantidade em mols de SO2 despejados na atmosfera durante a queima deste carvão, em um dia normal, é (Dados: S = 32,0 g/mol; C = 12,0 g/mol; H = 1,0 g/mol; O = 16 g/mol; N = 14 g/mol)
As minas de columbita e tantalita, minérios que produzem o composto coltan, exterminaram a maioria da população de gorilas e elefantes da República Democrática do Congo. Sua produção envolve, além da matança de animais, profunda exploração humana e ambiental. O coltan é um mineral importante para a fabricação de celulares, TVs de plasma, notebooks, câmeras digitais, satélites artificiais e diversas outras tecnologias. E suas matérias-primas, columbita e tantalita, têm seu maior foco de extração na África, que corresponde a 80% de todo o coltan utilizado pelas indústrias eletroeletrônicas do mundo. Os métodos de extração são rudimentares e promovem profunda exploração humana. São camponeses, prisioneiros de guerra, refugiados de guerra e crianças que extraem columbita e tantalita, sempre vigiados por militares. Os resultados são a vedação do direito das crianças à escola, mortes por desabamentos de túneis, doenças por falta de água limpa, saneamento e alimento, a disputa de grupos armados por cada mina, mortes de crianças (estima-se que cada quilo de coltan implicou a morte de duas crianças), transformação de bosques e campos agrícolas em lodaçais, desalojamentos forçados, violação de mulheres e meninas etc. As consequências ambientais também são alarmantes: para a extração de coltan, invadiram parques ecológicos nacionais da República Democrática do Congo, e matou-se 80% da população de elefantes e 90% da de gorilas do país, levando sua população quase à extinção local. Afirma-se que a maioria das multinacionais fabricantes de celulares está envolvida na compra do coltan congolês e na manutenção de governos corruptos e de guerras pela extração das matérias-primas desse mineral. O coltan é um exemplo gritante de como o capitalismo passa por cima da dignidade humana e da vida animal para o almejamento do lucro e do atendimento de “necessidades” não tão necessárias e de como a indústria corporativa de hoje não tem qualquer senso de responsabilidade socioambiental, nem mesmo de respeito à vida. Na impossibilidade de um boicote total às empresas compradoras do coltan congolês, vale as pessoas tentarem comprar o mínimo possível de eletroeletrônicos portáteis, pelo bem dos animais humanos e não humanos que vêm sendo explorados e massacrados na República Democrática do Congo.
SOUZA, ROBSON FERNANDO. Minas de coltan mataram maioria dos elefantes e gorilas do Congo. Disponível em:. Acesso:<http://www.anda.jor.br/21/06/2012/minas-de-coltan-mataram-maioria-dos-elefantes-e-gorilas-do-congo> 01 maio 2017.
A columbita, um mineral rico em nióbio, possui a fórmula molecular FeNb2O6 e faz parte da pauta de exportação mineral do Brasil, tendo sido exportadas, no ano de 2012 cerca de 71 mil toneladas do minério. A quantidade de nióbio exportada pelo Brasil em 2012 foi de, aproximadamente, (Dados: Fe= 56 g/mol, Nb=93 g/mol e O=16,0 g/mol).

4 Li (s) + O2 (g) → 2 Li2O (s)
A massa de lítio necessária para reagir completamente com 3,2 kg de oxigênio é, em quilogramas,
Massas molares: Li: 7 g/mol O: 16 g/mol
Massas molares em g/mol: C = 12,0 N = 14,0 O = 16,0 Na = 23,0 Cl = 35,5
Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
KMnO4 (s) + HCl (aq) → KCl (aq) + MnCl2 (aq) + Cl2 (g) + H2O (l)
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.
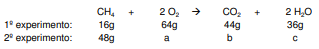
A. H2SO4 (aq) + NaOH (aq) → NaHSO4 (aq) + H2O (l) B. H2SO4 (aq) + BaCl2 (aq) → BaSO4 (s) + HCl (aq) C. H2SO4 (aq) + (NH4)2CO3 (aq) → (NH4)2SO4 (aq) + H2O (l) + CO2 (g)
Sobre essas reações, analise as proposições
I. A reação A é uma reação de neutralização, entre um ácido forte e uma base forte. II. Os coeficientes estequiométricos para a reação B são 1:2:1:2 III. A reação B é uma reação de oxirredução e está balanceada corretamente. IV. A reação C é uma reação de precipitação. V. Os coeficientes estequiométricos para a reação C são 1: 1: 1: 1: 1. VI. A reação A está balanceada e os coeficientes estequiométricos são 1:1:1:1.
Assinale a alternativa correta.
