Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões
Selênio - Assim como a vitamina E, esse mineral possui grande capacidade antioxidante, ou seja, neutraliza a ação dos radicais livres (formados devido à ação dos raios solares, poluição, fumaça de cigarro, entre outros) no nosso corpo, retardando o processo de envelhecimento e evitando o desencadeamento de algumas formas de câncer. Castanha do Pará, alimentos marinhos, fígado, carne e aves são os alimentos mais ricos em selênio.
Disponível em:<http://www.vyaestelarnoticias.com.br/post/4688/alim> . Acesso em: 20 nov. 2018.
Comparando-se esses dois elementos, verificamos que o selênio, ao combinar, tende a adquirir carga negativa, enquanto o zinco tende a adquirir carga positiva.
Qual a fórmula do composto formado entre zinco e selênio.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Considerando apenas a equação I, a massa de azida necessária para a formação de 67,2 L
de N2 nas CNTP seria 130 g.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Na reação global, 10 mol de azida geram 16 mol de nitrogênio gasoso.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns
quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na
rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Considerando apenas a equação I, seriam necessários 650 mg de azida de sódio para gerar
336 mL de N2 nas CNTP.
Os astronautas da nave Apollo 13, durante o voo espacial, enfrentaram um sério imprevisto na viagem de retorno à Terra. Os filtros de hidróxido de lítio que eram utilizados para retirar o excesso de gás carbônico do ar da nave ficaram saturados após alguns dias. Este incidente levou a NASA a resolver este problema para futuras viagens espaciais, desenvolvendo uma técnica na qual utilizava a água da urina dos astronautas na reação com o óxido de lítio para formar o hidróxido de lítio. Este, por sua vez, era utilizado na absorção do gás carbônico do ar da nave levando à formação de carbonato de lítio e água. A quantidade de óxido de lítio, para futuras viagens, foi estimada com base na produção diária de 1,8 Kg de água de urina por astronauta.
De acordo com as informações do texto acima, assinale a proposição CORRETA.
Pelos cálculos da NASA, cada astronauta eliminaria, por dia, aproximadamente 3,6 Kg de gás
carbônico na nave espacial.
Os astronautas da nave Apollo 13, durante o voo espacial, enfrentaram um sério imprevisto na viagem de retorno à Terra. Os filtros de hidróxido de lítio que eram utilizados para retirar o excesso de gás carbônico do ar da nave ficaram saturados após alguns dias. Este incidente levou a NASA a resolver este problema para futuras viagens espaciais, desenvolvendo uma técnica na qual utilizava a água da urina dos astronautas na reação com o óxido de lítio para formar o hidróxido de lítio. Este, por sua vez, era utilizado na absorção do gás carbônico do ar da nave levando à formação de carbonato de lítio e água. A quantidade de óxido de lítio, para futuras viagens, foi estimada com base na produção diária de 1,8 Kg de água de urina por astronauta.
De acordo com as informações do texto acima, assinale a proposição CORRETA.
Cada astronauta deve produzir aproximadamente 4,8 Kg de hidróxido de lítio por dia.
Em uma indústria do Estado de São Paulo que produz ácido sulfúrico 98% a partir da queima de enxofre elementar, com capacidade de produção inicial de 600 toneladas por dia, ocorreu uma emissão de gás dióxido de enxofre (SO2). Essa emissão de gás ultrapassou as fronteiras da fábrica de ácido sulfúrico e atingiu a população do entorno. Várias pessoas apresentaram agravos à saúde relacionados ao caso, como irritação das vias aéreas, desmaios, vômitos e enjoos, demandando atendimento hospitalar de emergência em hospitais da região. Também foram acionados o Serviço de Atendimento Médico de Urgência (SAMU) e o Corpo de Bombeiros.
JÚNIOR, L.M.; LORENZI, R.L. Revista brasileira de saúde ocupacional. São Paulo: 32(116): 31-37, 2007. (Adaptado)
Sobre o assunto, é CORRETO afirmar que:
para a produção de 600 toneladas de ácido sulfúrico são necessárias cerca de 400 toneladas
de S.
Considerando o composto orgânico C5H10O, analise os seguintes itens:
I.butanoato de metila;
II.pentan-2-ona;
III.ácido pentanóico;
IV.pentanal.
São compostos que podem ser escritos usando a fórmula química acima apresentada somente os que constam nos itens
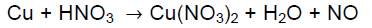
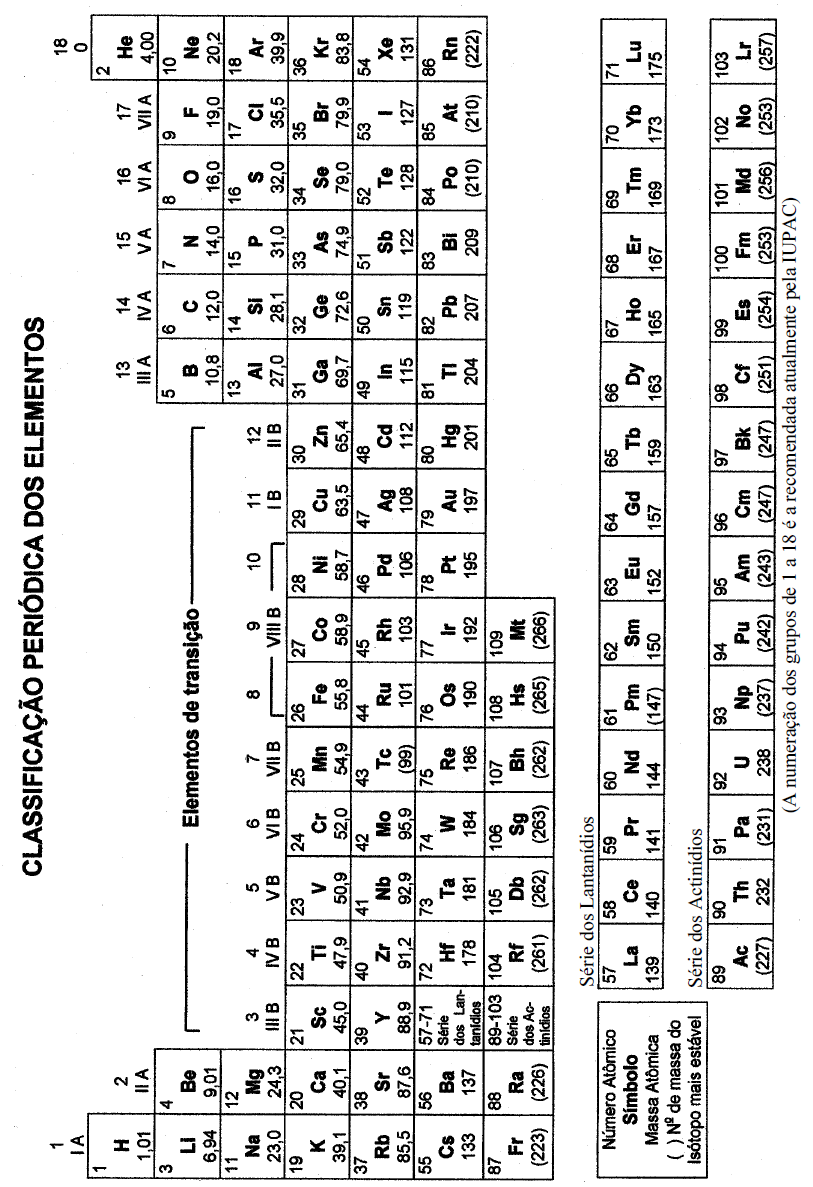
Quando balanceada, a soma dos menores coeficientes inteiros estequiométricos é igual a
Dados: MM(Na2 CO3 ) = 106g/mol
Na2 CO3 + HCl⬄ NaCl + H2 CO3
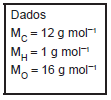
Dados: MM(H) = 1 g.mol-1 , MM(C) = 12 g.mol-1 e MM(O) = 16 g.mol-1

Quando se balancear uma reação química, deve-se obedecer à lei da conservação da massa. Ao se balancear reações de oxirredução, existe uma exigência adicional: os elétrons recebidos e doados devem estar balanceados.
Desta forma, é correto afirmar que a reação de oxirredução entre o íon permanganato e o íon oxalato em solução aquosa ácida, representada abaixo, estará balanceada quando os coeficientes estequiométricos forem, respectivamente:
MnO4- (aq) + C2O42- (aq) + H+ (aq) Mn2+ (aq) + H2O (l) + CO2 (g)
Mn2+ (aq) + H2O (l) + CO2 (g)

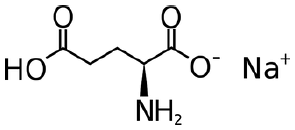
Se 0,1 g de glutamato monossódico for adicionado em um produto alimentício, a massa em miligramas de sódio proveniente desse sal será, aproximadamente:
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
Três frascos contêm volumes de três líquidos distintos. As suas massas são m₁ = 300 g, m₂ = 200 g e m₃ = 100 g. Os volumes de líquido contidos em cada frasco são V₁ = 280 mL, V₂= 240 mL e V₃ = 80 mL.
Ordene as densidades dos fluidos em ordem decrescente.