Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões
Em uma das etapas da produção do papel, ocorre a formação do bissulfito de sódio, conforme a seguinte reação não balanceada:
x Na2CO3 + y H2SO3 → z NaHSO3 + v CO2 + w H2O
Para que a reação esteja corretamente balanceada, os coeficientes x, y, z, v e w devem ser, respectivamente,
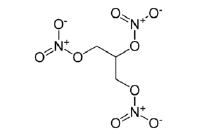 podemos afirmar que a trinitroglicerina:
podemos afirmar que a trinitroglicerina: A Aspirina, o medicamento mais conhecido e consumido no mundo, completou cem anos em 1999. Além de atuar como analgésico, é anti-inflamatório, antipirético e antiplaquetário. Seu princípio ativo é o ácido acetilsalicílico, C9H8O4 sintetizado pela reação do ácido salicílico, C7H6O3, com anidrido acético, C4H6O3 como mostrado pela equação química:
C7H6O3(s) + C4H6O3(l) → C9H8O4(s) + C2H4O2(l)
Calcule a massa de anidrido acético necessária para consumir completamente 2,00 . 102 g ácido salicílico.
Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16.
Pequenas quantidades de óxido nítrico (NO) ocorrem naturalmente em nossos corpos, nos quais age como um neurotransmissor, ajuda a dilatar os vasos sanguíneos e participa em outras mudanças psicológicas. Considere a reação de obtenção do óxido nítrico a partir de amônia e oxigênio, como mostra a equação química não-balanceada:
x NH3(g) + y O2(g) → z NO(g) + w H2O(g)
Após balancear a referida equação com os menores
números inteiros possíveis, a soma dos coeficientes
estequiométricos é:
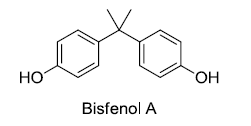
Acerca do bisfenol A, foram feitas algumas afirmações:
1) o bisfenol A é classificado como um composto aromático.
2) O bisfenol A apresenta apenas um carbono com hibridização sp3.
3) A fórmula molecular do bisfenol A é C15H16O2.
Está(ão) correta(s) a(s) afirmativa(s):
Dados: Massas molares em g.mol-1 : H = 1; C = 12; O = 16.
NaHCO3(s) → NaOH(s) + CO2(g)
Qual o volume em litros de gás carbônico produzido a uma temperatura de 27 °C e uma pressão de 1 atm pela decomposição de 4,2 g de bicarbonato de sódio (massa molar 84,00 g mol–1)?
C6H12O6(s) → 2 C2H5OH(l) + 2 CO2(g) ∆H°= −74,0 kJ.mol−1
Calcule a quantidade de glicose, em gramas, a ser fermentada para produzir 300 kJ de calor.
Dados: Massas molares em g.mol−1: H = 1; C = 12; O = 16.
x NH3(g) + y CuO(s) → t N2(g) + w Cu(s) + z H2O(g)
A soma dos coeficientes estequiométricos, x, y, t, w e z que tornam a equação balanceada é:
Ca3(PO4)2(s) + 3 H2SO4(aq) → 3 CaSO4(s) + 2 H3PO4(aq)
A mistura resultante de CaSO4 e H3PO4 é seca, pulverizada e espalhada pelos campos para plantações, onde o fosfato é dissolvido pelas águas das chuvas. Calcule a quantidade de ácido fosfórico produzida a partir de 1,00 kg de ácido sulfúrico.
Dados: Massas molares em g . mol−1: H = 1; O = 16; P = 31; S = 32.
v H2S + w Br2 + x H2O → y H2SO4 + z HBr
A soma dos coeficientes estequiométricos (v, w, x, y e z) após o balanceamento da equação é igual a:
Dado: massa molecular do metano = 16 g.mol-1.
w Ca3(PO4)2(aq) + x H2SO4(aq) → y H3PO4(aq) + z Ca(SO4)(aq)
Se utilizarmos 50 g de Ca3(PO4)2 e ácido sulfúrico em excesso, quantos gramas de ácido fosfórico podem ser obtidos através dessa reação?
Dados: massas moleculares em g.mol-1 : Ca3(PO4)2 = 310; H3PO4 = 98.
a KMnO4 + b Na2SO3 + c H2O → d MnO2 + e Na2SO4 + f KOH
A soma dos coeficientes estequiométricos a, b, c, d, e e f, que tornam a equação corretamente balanceada, deve ser:
1) X (Z =13) e Y (Z = 8)
2) A (Z = 19) e B (Z = 17)
As fórmulas dos compostos formados pelos átomos descritos em 1 e 2 são:
O gás butano (C4 H10) é um combustível não renovável derivado do petróleo, cuja combustão incompleta ocorre quando a quantidade de oxigênio é insuficiente para que ocorra a combustão completa.
Considere a equação da reação de combustão incompleta do gás butano:
2C4 H10 (g) + 9O2 (g) 8CO (g) + 10H2 O (g)
A massa do gás monóxido de carbono (massa molar = 28 g/mol) formada quando 522 kg de gás butano (massa molar = 58 g/mol) sofrem combustão incompleta, numa reação com rendimento total, é de
Com base nos dados fornecidos, a fórmula da molécula e o símbolo dos elementos citados são, respectivamente:


