Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 888 questões
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
O número de mols de dióxido de enxofre, formado a partir da combustão de 1000L de Diesel S-10, é, aproximadamente,
Dado: Densidade do Diesel S-10 = 0,8 kg/L
Dados – M (g mol-1 ): O = 16; Al = 27; Fe = 56.
A partir de 5 toneladas de minério, a quantidade (em toneladas) de alumínio metálico produzida por eletrólise ígnea é mais próxima de:
Uma amostra de 30,695g de calcário (carbonato de cálcio) é aquecida a alta temperatura e se decompõe conforme a reação de calcinação
CaCO3(s) —> CaO(s) + CO2(g).
Após um aquecimento vigoroso, o calcário sofreu decomposição completa e depois de resfriado foi pesado e acusou 30,14g. Com base nestas informações, determine o volume de gás liberado na CNTP.
(DADO: C = 12, O = 16 , Ca =40)
Numa sessão de estudos, alunos do Ensino Médio necessitavam responder a questão que tinha a seguinte informação: S(g) + 3/2 O2(g) → SO3(g) ΔH = -94,4Kcal/mol que é a equação termoquímica de um problema.
Pode-se afirmar que quando 120g de SO3(g) são formados: (Dado: S = 32g, O = 16g)
INSTRUÇÃO: Para responder à questão, analise o texto e a estrutura a seguir.
Uma das preocupações do Comitê Olímpico Internacional é combater o doping de atletas nas Olimpíadas. Para isso, uma série de análises é realizada rotineiramente com amostras de urina colhidas dos atletas. Nessas análises, uma das substâncias pesquisadas é o THG, que é um esteroide anabolizante. Os métodos de análise são extremamente sensíveis, sendo possível detectar THG em uma concentração tão baixa como 1 ppb (uma parte por bilhão). Isso significa uma concentração em que há um bilionésimo de grama de THG para cada grama de amostra.
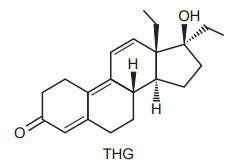
De acordo com as informações acima, assinale a
alternativa correta.
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
A energia eólica é a energia dos ventos, mas sua origem é a energia solar. Estima-se que 1 a 2% da energia solar converta-se em energia eólica. Isso porque a terra é aquecida pelo sol de forma irregular, gerando diferentes pressões atmosféricas em lugares distintos. O vento é o movimento do ar dos lugares com pressão mais alta para os de pressão mais baixa.
O aproveitamento da energia eólica em aerogeradores
é possível porque
TEXTO 8
IX
Horas depois, teve Rubião um pensamento horrível. Podiam crer que ele próprio incitara o amigo à viagem, para o fim de o matar mais depressa, e entrar na posse do legado, se é que realmente estava incluso no testamento. Sentiu remorsos. Por que não empregou todas as forças, para contê-lo? Viu o cadáver do Quincas Borba, pálido, hediondo, fitando nele um olhar vingativo; resolveu, se acaso o fatal desfecho se desse em viagem, abrir mão do legado.
Pela sua parte o cão vivia farejando, ganindo, querendo fugir; não podia dormir quieto, levantava-se muitas vezes, à noite, percorria a casa, e tornava ao seu canto. De manhã, Rubião chamava-o à cama, e o cão acudia alegre; imaginava que era o próprio dono; via depois que não era, mas aceitava as carícias, e fazia-lhe outras, como se Rubião tivesse de levar as suas ao amigo, ou trazê-lo para ali. Demais, havia-se-lhe afeiçoado também, e para ele era a ponte que o ligava à existência anterior. Não comeu durante os primeiros dias. Suportando menos a sede, Rubião pôde alcançar que bebesse leite; foi a única alimentação por algum tempo. Mais tarde, passava as horas, calado, triste, enrolado em si mesmo, ou então com o corpo estendido e a cabeça entre as mãos.
Quando o médico voltou, ficou espantado da temeridade do doente; deviam tê-lo impedido de sair; a morte era certa.
— Certa?
— Mais tarde ou mais cedo. Levou o tal cachorro?
— Não, senhor, está comigo; pediu que cuidasse dele, e chorou, olhe que chorou que foi um nunca acabar. Verdade é, disse ainda Rubião para defender o enfermo, verdade é que o cachorro merece a estima do dono; parece gente.
O médico tirou o largo chapéu de palha para concertar a fita; depois sorriu. Gente? Com que então parecia gente? Rubião insistia, depois explicava; não era gente como a outra gente, mas tinha coisas de sentimento, e até de juízo. Olhe, ia contar-lhe uma...
— Não, homem, não, logo, logo, vou a um doente de erisipela... Se vierem cartas dele, e não forem reservadas, desejo vê-las, ouviu? E lembranças ao cachorro, concluiu saindo.
Algumas pessoas começaram a mofar do Rubião e da singular incumbência de guardar um cão em vez de ser o cão que o guardasse a ele. Vinha a risota, choviam as alcunhas. Em que havia de dar o professor! sentinela de cachorro! Rubião tinha medo da opinião pública. Com efeito, parecia-lhe ridículo; fugia aos olhos estranhos, olhava com fastio para o animal, dava-se ao diabo, arrenegava da vida. Não tivesse a esperança de um legado, pequeno que fosse. Era impossível que lhe não deixasse uma lembrança.
(ASSIS, Machado de. Quincas Borba. São Paulo: Ática, 2011. p. 30-31.)
Note e adote: Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
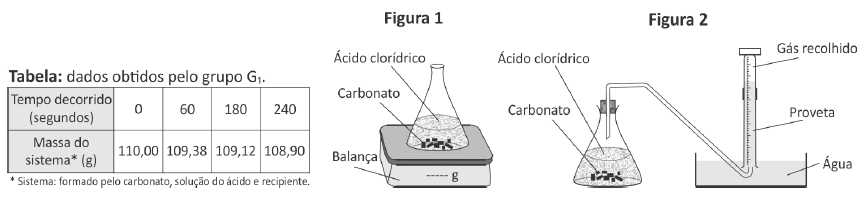
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
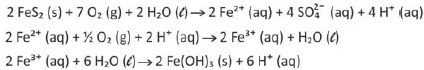
Considerando a equação química que representa a
transformação global desse processo, as lacunas da frase
“No intemperismo sofrido pela pirita, a razão entre as
quantidades de matéria do FeS2(s) e do O2(g) é __________,
e, durante o processo, o pH do solo __________” podem ser
corretamente preenchidas por
O mercúrio é um metal prateado que, em temperatura ambiente, é líquido e inodoro. Quando a temperatura é aumentada, transforma-se em vapor tóxico e corrosivo. Trata-se de produto perigoso à saúde quando inalado, ingerido ou em contato, causando irritação na pele, olhos e vias respiratórias. Uma forma de obtenção de mercúrio se dá por ustulação do sulfeto de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
Sabendo-se que o sulfeto de mercúrio II possui 70 % de pureza, a massa de mercúrio produzida pela ustulação de uma tonelada do composto é

