Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 873 questões
Pode-se concluir corretamente que, na combustão completa de 1 mol desse hidrocarboneto, as quantidades de matéria, e CO2 e de H2O produzidas são, em mol, respectivamente, iguais a
AlP (s) + 3 H2O (l) → Al (OH)3 (s) + PH3 (g)
Considerando que toda a massa de fosfeto de alumínio reagiu com a água e que o rendimento da reação é 100%, o volume aproximado de fosfina produzido no local, em litros, é
Dados: Volume molar dos gases nas condições descritas: 30 L/mol
Massas molares em g/mol: Al = 27, P = 31

4 Li (s) + O2 (g) → 2 Li2O (s)
A massa de lítio necessária para reagir completamente com 3,2 kg de oxigênio é, em quilogramas,
Massas molares: Li: 7 g/mol O: 16 g/mol
Leia o texto para responder a questão.
Em seu livro Tratado Elementar de Química, publicado em 1789, Antonie Lavoisier estabeleceu uma nova nomenclatura para diversas substâncias químicas. Alguns exemplos, extraídos desse livro, são dados no quadro.
Nome antigo Nome proposto por Lavoisier Nome atual
ar vital oxigênio oxigênio
ar inflamável hidrogênio hidrogênio
ar fixo ácido carbônico dióxido de carbono
ácido vitriólico ácido sulfúrico ácido sulfúrico
vitríolo azul; vitríolo de cobre sulfato de cobre sulfato de cobre (II)
ácido marinho ácido muriático ácido clorídrico
sal marinho muriato de soda cloreto de sódio
soda aerada; soda efervescente carbonato de soda carbonato de sódio
Esse gás é o que, antigamente, era chamado de
Assinale a alternativa que apresenta a fórmula molecular e a quantidade mínima, em kg, de gás oxigênio necessária para a combustão completa de 5,6 kg desse combustível.
Massas Molares: H = 1 g/mol O = 16 g/mol C = 12 g/mo
O besouro-bombardeiro consegue afastar seus predadores, lançando sobre eles um jato quente e repelente de quinona, substância produzida em seu abdômen, através da reação química entre hidroquinina e peróxido de hidrogênio. O fenômeno pode ser representado pela equação:
C6 H6 O2(aq) + H2O2(aq) → C6 H4O2(aq) + 2H2 O ∆H = –204 kJ/mol
Hidroquinona Quinona
Massas molares em g/mol: C = 12,0 N = 14,0 O = 16,0 Na = 23,0 Cl = 35,5
Dados: Massa Molar: O = 16 g/mol

Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
KMnO4 (s) + HCl (aq) → KCl (aq) + MnCl2 (aq) + Cl2 (g) + H2O (l)
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.
O nitrato de amônio NH4NO3(s) é utilizado na agricultura como fertilizante para promover o crescimento e a frutificação de plantas, entretanto é um explosivo potente que, ao se decompor, libera, rapidamente, um volume muito grande de gases de acordo com a equação termoquímica.
A partir dessas informações, dessa equação termoquímica e admitindo-se que os gases desprendidos na explosão são ideais, é correto afirmar:
A indústria de alimentos e o Ministério da Saúde firmaram compromisso de reduzir gradualmente o teor de sódio, em 16 tipos de alimentos, até 2020. Segundo o Ministério da Saúde, o brasileiro consome, em média, 9,6g diárias de sal, NaCl, quando a Organização Mundial de Saúde, OMS, recomenda o consumo máximo de 5,0g diárias. O excesso de sal na dieta está associado a maior risco de doenças, como hipertensão, problemas cardiovasculares, renais e câncer.
Uma análise dessas informações e da tabela permite
corretamente afirmar:
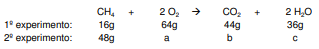
A. H2SO4 (aq) + NaOH (aq) → NaHSO4 (aq) + H2O (l) B. H2SO4 (aq) + BaCl2 (aq) → BaSO4 (s) + HCl (aq) C. H2SO4 (aq) + (NH4)2CO3 (aq) → (NH4)2SO4 (aq) + H2O (l) + CO2 (g)
Sobre essas reações, analise as proposições
I. A reação A é uma reação de neutralização, entre um ácido forte e uma base forte. II. Os coeficientes estequiométricos para a reação B são 1:2:1:2 III. A reação B é uma reação de oxirredução e está balanceada corretamente. IV. A reação C é uma reação de precipitação. V. Os coeficientes estequiométricos para a reação C são 1: 1: 1: 1: 1. VI. A reação A está balanceada e os coeficientes estequiométricos são 1:1:1:1.
Assinale a alternativa correta.
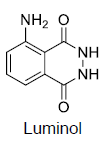
Analise as proposições sobre a molécula de luminol.
I. Realiza ligações de hidrogênio e apresenta as funções químicas amina e azida. II. Sua fórmula molecular é C8H7N3O2, e possui em sua estrutura somente carbonos com hibridização sp2 III. Apresenta ligações covalentes sigma e pi em sua estrutura.
Assinale a alternativa correta.
2 H2(g) + O2(g) → 2 H2O(g) ∆H= - 483,6 kJ
A reação acima é uma reação:
Assinale a alternativa que apresenta o composto químico com o caráter iônico mais acentuado.
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
Estabelecida à devida proporção, assinale a alternativa correta.