Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões
Na coluna da direita abaixo, estão relacionadas algumas substâncias químicas; na da esquerda, características dessas substâncias.
Associe adequadamente a coluna da esquerda à da direita.
( ) Sólido com alta maleabilidade e brilho metálico
( ) Gás com coloração esverdeada
( ) Gás pouco denso e altamente inflamável
( ) Substância condutora de eletricidade quando fundida
1. Cloreto de sódio
2. Ouro
3. Cloro
4. Bromo
5. Hidrogênio
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
ANO INTERNACIONAL DA TABELA PERIÓDICA
Há 150 anos, a primeira versão da tabela periódica foi elaborada pelo cientista Dimitri Mendeleiev. Trata-se de uma das conquistas de maior influência na ciência moderna, que reflete a essência não apenas da química, mas também da física, da biologia e de outras áreas das ciências puras. Como reconhecimento de sua importância, a UNESCO/ONU proclamou 2019 o Ano Internacional da Tabela Periódica.
Na tabela proposta por Mendeleiev em 1869, constavam os 64 elementos químicos conhecidos até então, além de espaços vazios para outros que ainda poderiam ser descobertos. Para esses possíveis novos elementos, ele empregou o prefixo “eca”, que significa “posição imediatamente posterior”. Por exemplo, o ecassilício seria o elemento químico a ocupar a primeira posição em sequência ao silício no seu grupo da tabela periódica.
Em homenagem ao trabalho desenvolvido pelo grande cientista, o elemento químico artificial de número
atômico 101 foi denominado mendelévio.
Considere uma amostra laboratorial de 0,43 g de mendelévio.
O número de átomos presentes nessa amostra equivale a:
Com o reflorestamento, é possível minimizar os efeitos do aquecimento global, tendo em vista que uma árvore consegue captar, em média, 15,6 kg do CO2 lançado na atmosfera por ano. Sabe-se que, na combustão completa da gasolina, todos os átomos de carbono são convertidos em moléculas de CO2.
Admitindo que 1 litro de gasolina contém 600 g de isoctano (C8H18) e 200 g de etanol (C2H6O), no período de 1 ano, uma árvore será capaz de captar o CO2 emitido na combustão completa de x litros de gasolina.
O valor de x corresponde, aproximadamente, a:
O Cardanol é um fenol obtido do líquido da castanha de caju (LCC), a partir do processo de aquecimento a que as castanhas são submetidas para fins alimentícios, de modo a romper a casca externa e liberar o óleo.
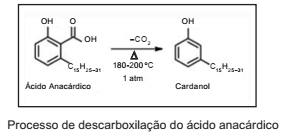
Sendo o LCC um subproduto de agronegócio do caju e
correspondente a, aproximadamente, 25% do peso da castanha, supõe-se que 5% desse líquido seja o ácido anacárdico. Assim, para produzir 5.96 toneladas de Cardanol,
supondo que sua massa molar seja de aproximadamente,
298 g/mol, a quantidade necessária de castanhas em toneladas é de:
O TBT (M.M = 291 g/mol) é um composto polar, hidrofóbico e lipofílico que foi introduzido no mercado nos anos 40. É componente de tintas anti-incrustantes, utilizadas em cascos de barcos, redes e jaulas de aquacultura a fim de impedir a fixação de organismos como algas e invertebrados (mexilhão, cracas, etc.). Além disso, o TBT é utilizado também na agricultura como pesticida, conservante de madeiras e, numa escala menor, em desinfetantes e em tratamentos algicidas em materiais de construção. A sua elevada difusão no meio marinho tornou-se uma preocupação ambiental em nível mundial. Atualmente, é considerada a substância mais tóxica produzida pelo homem.
A composição centesimal do TBT é de 49.49% de Carbono, 9.62% de Hidrogênio e 40.89% de Estanho e sua fórmula molecular é:
Os cosméticos, como batons e rímeis, buscam realçar o encanto da beleza. Porém, o uso desses produtos pode, também, causar desencantamento em função dos constituintes químicos tóxicos que possuem. Em batons, pode haver presença de cádmio, chumbo, arsênio e alumínio. A FDA (Food and Drug Administration) e a ANVISA (Agência Nacional de Vigilância Sanitária) preconizam limites máximos de metais apenas para corantes orgânicos artificiais utilizados como matéria-prima na fabricação de cosméticos.
Considerando que um determinado batom possua concentração de chumbo igual a 1,0 mg Kg−1 e que a estimativa máxima de utilização deste cosmético ao longo do dia seja de 100 mg, assinale a alternativa que representa, correta e aproximadamente, o número de átomos de chumbo em contato com os lábios ao longo de um dia.
Dados:
Massa molar de chumbo = 207 g mol−1
Constante de Avogadro = 6,0 x 1023 mol−1
Medicamento é um produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico. A química orgânica é fundamental para o desenvolvimento de novos fármacos e o crescimento da indústria farmacêutica.
Dois dos princípios ativos de medicamentos mais
utilizados pelos brasileiros são ilustrados a seguir:
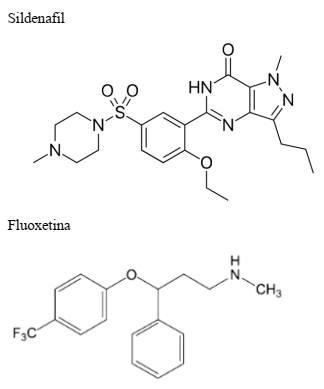
Em relação aos compostos apresentados, assinale a
alternativa CORRETA:
Nicotina, um dos principais constituintes do cigarro, é um alcaloide, encontrado nas folhas do tabaco (Nicotiana tabacum), planta originária das Américas, sendo a molécula responsável pela dependência.
Sua composição porcentual, em massa, é 74,1% de carbono, 8,6% de hidrogênio e 17,3% de nitrogênio.
Assinale a alternativa que indica CORRETAMENTE a fórmula mínima da nicotina.
Vinagre é uma mistura homogênea cujo principal constituinte é o ácido acético. Um estudante de química analisou uma amostra de uma garrafa de 500mL de vinagre de maçã, em que, no rótulo, há a informação de que o teor do ácido acético presente na solução é de 4,2% m/v.
Considerando que o ácido acético é o único composto de caráter ácido do vinagre, analise as proposições sugeridas pelo estudante após as análises.
I- A molaridade do ácido acético na amostra analisada é 0,7mol/L.
II- Ao titular 20mL desse vinagre com hidróxido de sódio 1mol/L, foram gastos 50mL da base.
III- Uma cozinheira que utiliza 6,3g de vinagre por dia, durante 30 dias, irá utilizar 9 garrafas.
Está(ão) CORRETA(S) a(s) afirmativa(s):
A glicose, importante açúcar na alimentação de muitos seres vivos, possui fórmula igual a C6 H12O6 .
Sobre a glicose, é possível AFIRMAR que:
Um grupo de alunos do curso de Química, ao entrar no laboratório para uma atividade, deparou-se com alguns recipientes não rotulados, embora todos contivessem uma substância líquida e incolor.
Considerando as substâncias, os acadêmicos determinaram as seguintes propriedades para reconhecimento: 1) massa, 2) volume, 3) ponto de ebulição, 4) densidade.
Com base nestas informações, indique quais propriedades possibilitaram aos acadêmicos a identificação das substâncias:
O fermento químico é um ingrediente muito utilizado na cozinha para fazer crescer as massas, sendo a principal a de farinha de trigo. O crescimento ocorre devido à formação de gás carbônico dentro da massa, quando o fermento é adicionado a ela. Graças a ele, podemos provar alimentos macios e de digestão fácil. Observe a reação entre as substâncias que compõem um determinado fermento químico, quando o mesmo é adicionado à massa de um alimento que está sendo produzido:
8NaHCO3 + 3Ca(H2PO4)2 → Ca3(PO4)2 + 4Na2HPO4 + 8CO2 + 8H2O
Considerando a reação dada, qual é a massa, em gramas, de CO2 produzido quando 60 gramas de NaHCO3 reagem totalmente com Ca(H2PO4)2?
Dados: NaHCO3: 84 g/mol; CO2: 44 g/mol
Leia o texto para responder a questão.

Voando na altitude de cruzeiro com uma velocidade média, em relação ao solo, de 800 km/h, um Boeing 737-800 percorreu uma distância de 2400 km.
Considere que:
• o QAV é constituído por hidrocarbonetos cujas cadeias
carbônicas contêm, em média, 12 átomos de carbono
e 26 átomos de hidrogênio, apresentando massa molar
média de 170 g/mol;
• a combustão do QAV na altitude de cruzeiro é completa.
De acordo com os dados, a massa de CO2
(g) gerada pela
combustão do QAV na distância percorrida pelo avião foi próxima de
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
O dióxido de titânio, além de ser empregado como aditivo alimentar, é comumente usado para pigmentação branca em tintas, papel e plásticos. É também um ingrediente ativo, em protetores solares baseados em minerais, usado para a pigmentação com o objetivo de bloquear a luz ultravioleta. Além disso, o óxido também é usado em alguns chocolates para dar uma textura suave; em donuts, para fornecer cor; e em leites desnatados, para dar uma aparência mais brilhante, mais opaca, o que torna o produto mais saboroso.
Uma das reações utilizadas para a sua produção é a cloração de um mineral de titânio (ilmenita) cuja equação é a seguinte:
x FeTiO3 (s) + y Cl2 (g) + z C(s) → a FeCl2 (s) + bTiO2(s) + c CO2 (g)
Os números para os coeficientes x, y, z, a, b, c, que tornam
essa equação balanceada, são, respectivamente:
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
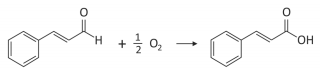
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.
Uma amostra sólida, sem cavidades ou poros, poderia ser constituída por um dosseguintes materiais metálicos: alumínio, bronze, chumbo, ferro ou titânio. Para identificá‐la, utilizou‐se uma balança, um recipiente de volume constante e água. Efetuaram‐se as seguintes operações: 1) pesou‐se a amostra; 2) pesou‐se o recipiente completamente cheio de água; 3) colocou‐se a amostra no recipiente vazio, completando seu volume com água e determinou‐se a massa desse conjunto. Os resultados obtidos foram os seguintes:
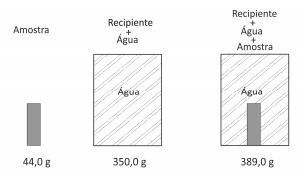
Dadas as densidades da água e dos metais, pode‐se concluir que a amostra desconhecida é constituída de
Note e adote:
Densidades (g/cm3 ):
água = 1,0; alumínio = 2,7; bronze = 8,8;
chumbo = 11,3; ferro = 7,9; titânio = 4,5.
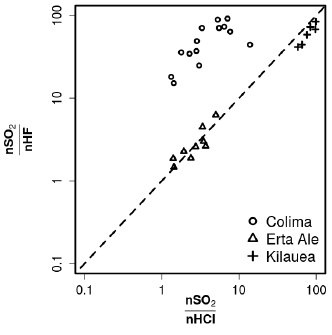
De acordo com a figura, em relação às quantidades de gases dissolvidos no magma, é correto afirmar que as concentrações de SO2 são maiores que as de HF e de HCl


