Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões
“Só para você ter ideia dos riscos, organizações internacionais de saúde indicam que a ingestão diária de sódio para cada pessoa seja de 2,3 gramas. O glutamato é composto por 21% de sódio e, com certeza, não será o único tempero a ser acrescentado ao seu almoço ou jantar. Além disso, o realçador (glutamato) só conta um terço do nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g·mol-1: sódio = 23, cloreto = 35,5, glutamato monossódico = 169.
Para tornar a argumentação do artigo mais consistente do ponto de vista químico, você sugeriria a seguinte reescrita dos trechos destacados:
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.
Um certo metal (M), de massa molar igual a 48 g mol-1 , forma um sal de cloreto bastante reativo, que em água sofre hidrólise e produz o óxido desse metal. Verificou-se que na composição de 80 g do óxido, 48 g correspondem a massa apenas do metal.
(Dado: massa molar do oxigênio igual a 16 g mol-1 )
A fórmula mínima desse óxido é:
HABER-BOSCH: O PROCESSO RESPONSÁVEL POR ALIMENTAR
MUITA GENTE NESTE PLANETA
Estima-se que aproximadamente 45% da população mundial só estão aqui em função do desenvolvimento do processo Haber-Bosch e da produção de amônia. Sem os fertilizantes nitrogenados, nós não teríamos condições de produzir a quantidade de alimentos necessária para alimentar a população que temos hoje no mundo, que está em torno de 7,3 bilhões de pessoas, com tendência a chegar a 9 ou 10 bilhões por volta de 2050. O processo Haber-Bosh descreve uma técnica para obtenção da amônia a partir do nitrogênio do ar atmosférico e do hidrogênio e de fatores como altas temperaturas e pressão.
Disponível em:<https://www.acontecenoticias.com.br/single-post/2017/09/27/Haber-Bosch-O-Processo-Respons%C3%A1velpor-Alimentar-Muita-Gente-Neste-Planeta> . Acesso em: 01/04/18.
A equação não balanceada que descreve a reação de produção de amônia é mostrada a seguir:
N2(g) +H2(g) ⇌ NH3(g)
Ao reagir 50 mols de N2 e 30 mols de H2, qual a quantidade de NH3 produzida em gramas se a reação de síntese for completa?
Dados: N=14 g/mol; H=1g/mol
A dipirona (C13H16N3O4SNa) é um medicamento muito utilizado para aliviar a dor e para baixar a febre. Ana ao observar que seu filho João de 3 anos estava com febre, por indicação médica, diluiu 10 gotas do medicamento de concentração 500 mg/mL em água e deu ao seu filho. Qual a quantidade de moléculas de dipirona ingeridas por João?
Dados: 1mL = 20 gotas; Constante de Avogrado = 6x1023 moléculas/mol C=12g/mol; O=16g/mol; N=14g/mol; S=32g/mol; H=1g/mol; Na=23g/mol.
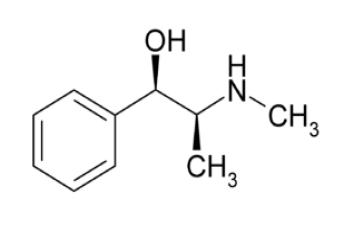 Com relação a essa molécula, podemos afirmar,
respectivamente, que sua fórmula molecular e os grupos
funcionais presentes correspondem às funções orgânicas:
Com relação a essa molécula, podemos afirmar,
respectivamente, que sua fórmula molecular e os grupos
funcionais presentes correspondem às funções orgânicas:Considere a representação tridimensional da molécula orgânica mostrada abaixo.
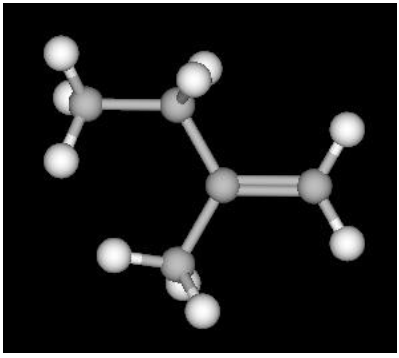
Sobre essa molécula, é correto afirmar que
Assinale com V (verdadeiro) ou F (falso) as afirmações abaixo, referentes a compostos inorgânicos.
( ) O fosfato de sódio, embora seja considerado um composto iônico, possui ligações covalentes no íon fosfato.
( ) Compostos iônicos tendem a ter pontos de fusão e ebulição mais elevados do que os compostos moleculares.
( ) BeF2 não obedece à regra do octeto.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Em experimento bastante reproduzido em vídeos na internet, é possível mostrar que uma lata contendo refrigerante normal afunda em um balde com água, ao passo que uma lata de refrigerante dietético flutua.
Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
A propriedade física a que se deve esse comportamento é a ........ e pode ser explicada pela ........ .
Considerando as semirreações
BiO3- + 6H+ + 2e- → Bi3+ + 3H2O e Mn2+ + 4H2O → MnO4- + 8H+ + 5e- , é correto afirmar que o coeficiente do íon MnO4- na reação global devidamente balanceada é
A coniina é um alcaloide venenoso. Suas propriedades tóxicas eram conhecidas desde a antiguidade e já eram usadas na época dos gregos como um veneno para ser administrado àqueles condenados à morte.
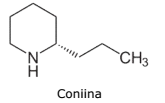
Atente ao que se diz a seguir sobre essa substância:
I. Contém carbono terciário.
II. É um composto aromático.
III. É um composto nitrogenado heterocíclico.
IV. Tem fórmula molecular C8H17N.
Está correto o que se afirma somente em
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
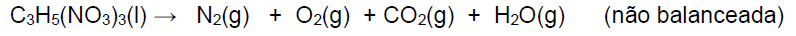
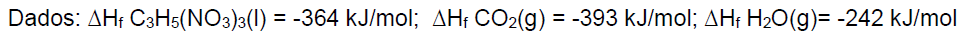
De posse das informações, assinale a alternativa que representa a variação de entalpia da
reação acima, em kJ por mol de nitroglicerina.
Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
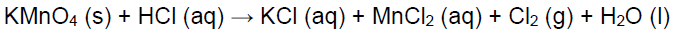
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.

