Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões
Um canudo de plástico e outro de vidro borossilicato possuem mesmo volume e densidades de 0,90 g/cm3 e 2,25 g/cm3 , respectivamente.
A razão entre as massas do canudo de plástico e do canudo de vidro corresponde a:
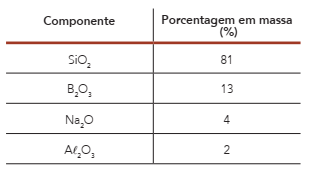
A tabela abaixo apresenta a composição química de uma amostra de 500 g de vidro borossilicato.
Considere as informações a seguir sobre a perfluorodecalina, substância utilizada no preparo de sangue artificial.
Fórmula mínima: C5 F9 .
Massa molar: 462 g/mol.
Sua fórmula molecular é representada por:
Em seu ciclo, um átomo de carbono pode ser incorporado a diferentes compostos por meio de processos contínuos de decomposição e formação de novas moléculas. Os átomos de carbono deste caderno de prova, por exemplo, serão degradados ao longo do tempo e, posteriormente, incorporados a outros seres vivos.
Considere que, ao se degradarem, os átomos de carbono deste caderno se distribuam igualmente entre os 7,5 bilhões de habitantes do planeta.
Sabendo que o caderno possui 90 g de massa, com 45% de carbono em sua composição, o número de átomos que será incorporado em cada habitante é igual a:
O sulfeto de níquel (II), NiS, ocorre na natureza como um mineral relativamente raro, a millerita. Uma de suas ocorrências é em meteoritos. Para se determinar a quantia de NiS em uma amostra do mineral, ela é tratada com ácido nítrico para liberar o níquel.
NiS(s) + 4HNO3(aq) → Ni(NO3)2(aq) + S(s) + 2NO2(g) + 2H2O(l)
A solução aquosa de Ni(NO3)2 é então tratada com o composto orgânico dimetilglioxima (C4H8N2O2 – DMG) para formar o sólido vermelho Ni(C4 H7N2O2 )2(s) de acordo com a reação:
Ni(NO3 )2(aq) + 2 C4 H8 N2 O2(aq) → Ni(C4 H7 N2 O2 ) 2(s) + 2 HNO3(aq
Se uma amostra de 0.468 g contendo millerita
produz 0.206 g do sólido vermelho Ni(C4
H7
N2
O2
)2(s) , a
porcentagem de NiS na amostra é:
Na produção de sabão, uma amostra de 100 g de hidróxido de sódio reage com a estearina, de acordo com a reação não balanceada a seguir:
(C17H35COO)3C3 H5(s) + NaOH(aq) → C17H35COONa(s) + C3H5 (OH)3( l )
Considerando que, a partir de 100 g de hidróxido de
sódio, foram obtidos 512 g de estearato de sódio, o rendimento
deste procedimento é aproximadamente igual a
Um volume de 16.42 mL de uma solução de permanganato de potássio 0.1327 M é necessário para oxidar 20.00 mL de uma solução de FeSO4 em meio ácido.
Considere que a equação não balanceada representativa da reação é:
Fe2+ + MnO4 − + H+ → Mn2+ + Fe3+ + H2O
A concentração da solução do sal de ferro será
aproximadamente:
A metilona – um derivado das anfetaminas – produz efeitos semelhantes aos do ecstasy (MDMA), sendo, portanto, um estimulante gerador de euforia e de mais energia e capaz, também, de alterar a percepção sensorial.
Observe a fórmula estrutural da metilona, apresentada a seguir.
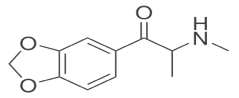
A metilona possui:
O número de mols de dióxido de enxofre, formado a partir da combustão de 1000L de Diesel S-10, é, aproximadamente,
Dado: Densidade do Diesel S-10 = 0,8 kg/L
Considerando-se que, em alguns suplementos alimentares, existam 0,105 x 1020 moléculas da vitamina E, por comprimido, fórmula molecular C29H50O2, e que o número de Avogadro é 6 x 1023 mol-1, o número de comprimidos que deve ser consumido em um mês (30 dias) para manter a dose recomendada diária é cerca de
NaOH + H3PO4 → Na3PO4 + H2O
Sabendo-se que Na=23, O=16, H=1 e P=31, qual a massa de ácido fosfórico (H3PO4) necessária para a obtenção de 200g de água?
Dois elementos genéricos X e Y apresentam as seguintes distribuições eletrônicas por camadas: X(2, 8, 8, 1) e Y(2, 8, 18, 6). Considerando-se uma provável ligação química entre esses elementos (X e Y), afirma-se:
I O átomo X ganha 1 elétron e transforma-se em um cátion monovalente.
II A fórmula do composto formado é X2Y.
III A ligação que ocorre entre eles é do tipo iônica.
IV O átomo Y cede 2 elétrons e transforma-se em um ânion bivalente.
São corretas apenas as afirmações:
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa)  sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,
Dados de massas molares em g∙mol-1: sulfato de cobre (II) pentaidratado = 250; hidróxido de cálcio = 74.
Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
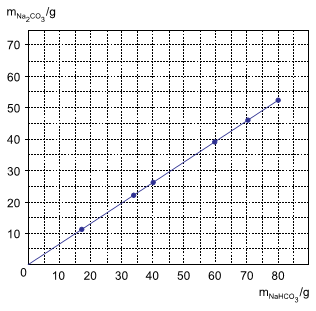
Os dados do gráfico permitem concluir que as massas de
carbonato de sódio e bicarbonato de sódio nessa reação
estão relacionadas pela equação 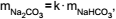 e
que o valor aproximado de k é
e
que o valor aproximado de k é
Considerando a equação de formação da glicose não balanceada C + H2 + O2 → C6H12O6 , atente às seguintes equações:
I. C + O2 → CO2 ΔH = −94,1 kcal
II. H2 + ½ O2 → H2O ΔH = −68,3 kcal
III. C6H12O6 + 6O2 → 6CO2 + 6 H2O ΔH = −673,0 kcal
A massa de glicose formada a partir da reação de 14,4 g de carbono e sua entalpia de formação em kcal/mol serão, respectivamente,
Na Onda do Sódio
Eu sou o Sódio,
não tenho ódio.
Quando estou com a água,
não guardo mágoa.
Explodo de emoção,
nessa reação.
Não esbanjo meu potencial,
sou muito legal.
Minha família é a um,
me dou bem com cada um.
Meu período é o terceiro,
de quem eu sou parceiro.
Existe um halogênio especial,
me ligo a todos, mas com o cloro...
Eu adoro!
Que união genial!
Me envolvo em muitas reações,
com diferentes emoções.
Base, cátion, sal...
Eu sou mesmo radical!
(Poesia de autoria de equipe participante da Gincana de Química (2011) da
Universidade Federal do Ceará. Disponível em:<http://www.quimica.ufc.br>
No trecho “Quando estou com a água, não guardo mágoa. Explodo de emoção”, o autor descreve a maneira altamente energética com que sódio metálico reage com água, conforme equação a seguir:
a Na(s) + b H2O(l)→ c NaOH(aq) + d H2(g)
Na equação balanceada, os valores dos coeficientes estequiométricos a, b, c e d são, respectivamente:



