Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 888 questões
CHCl3(g) + Cl2(g)
 CCl4(g) + HCl(g)
CCl4(g) + HCl(g)
Considerando reagir 11,9 g de CHCl3 em um ambiente contendo gás cloro em excesso, qual a massa aproximada, em gramas, de HCl(g) produzida se a reação apresentar 75 % de rendimento?
O alumínio é obtido pela eletrólise da bauxita. Nessa eletrólise, ocorre a formação de oxigênio que reage com um dos eletrodos de carbono utilizados no processo. A equação não balanceada que representa o processo global é:
Al2O3 + C
 CO2 + Al
CO2 + Al Para 2 mols de Al2O3, quantos mols de CO2 e Al, respectivamente, são produzidos nesse processo?
Para demonstrar a aplicação dessas leis, um professor apresentou uma reação do tipo A + B → C + D e solicitou aos alunos que encontrassem os valores que deveriam substituir as letras x, y e z na tabela.
REAÇÃO A B C D 1º experimento 12 g 25 g x 17 g 2º experimento 30 g y 50 g z
Baseando-se nas leis mencionadas, os valores corretos obtidos pelos alunos foram
Duzentos gramas de carbonato de cálcio reagem com 96g de dióxido de enxofre produzindo sulfito de cálcio e dióxido de carbono. Assinale a alternativa que contém, respectivamente, a massa de sulfito de cálcio e o volume de dióxido de carbono, produzidos (nas CNTP) nessa reação.
Dados: Ca: 40 g/mol; S; 32 g/mol; O: 16 g/mol; C: 12 g/mol.
Considere a reação abaixo (não balanceada):
NH3 + O2 ➔ NO + H2O
O número de moléculas de NO formadas na reação da amônia (NH3) com 2,0 .1021 moléculas de oxigênio será:
Considere a equação química (não balanceada) para a combustão do etanol:
C2H6O(l) + O2(g) ➜ CO2(g) + H2O(l)
Dados: Entalpia de formação de C2H6O(l) = – 66 kcal/mol
Entalpia de formação de CO2(g) = – 94 kcal/mol
Entalpia de formação de H2O(l) = – 68 kcal/mol
A entalpia de combustão em kcal/mol será:
Fe2O3 + C →Fe + CO
(Dados: Massa molar do Fe2O3 = 160 g/mol; Massa molar do Fe = 56 g/mol) Quantos quilogramas de hematita são necessários para produzir 560 kg de Fe?
Supondo que 1 mol de NaOH reage com 1 mol de HCl e, levando-se em consideração a lei de conservação das massas de Lavoisier, quantos gramas de H2O seriam produzidos nesta reação?
INSTRUÇÃO: Para responder à questão, analise a representação do glifosato a seguir.
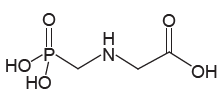
O uso de agrotóxicos é objeto de preocupações, pois o contato com doses elevadas no momento da aplicação tem causado sérios problemas de saúde a trabalhadores rurais. Esse problema se agrava quando os agricultores aplicam doses maiores do que as recomendadas, em uma tentativa de controlar pragas resistentes. O glifosato, por exemplo, no uso agrícola comum, é adquirido como uma solução com a concentração de 360 gramas por litro, sendo aplicados cinco litros por hectare (um hectare equivale a 10000 m²).
Sobre esse assunto, fazem-se as seguintes afirmativas.
I. Em uma aplicação de glifosato, cada hectare de lavoura recebe mais de 1,0×1023 moléculas desse herbicida.
II. Em uma molécula de glifosato há mais átomos de hidrogênio do que de oxigênio.
III. A concentração de glifosato na solução é de aproximadamente 2,1 mol/L.
Está/Estão correta(s) a(s) afirmativa(s)
NaN3 (s) → Na(s) + N2(g)
Analisando o texto, assinale a alternativa CORRETA.

 Na2SiO3(s) + CO2(g)
Na2SiO3(s) + CO2(g)
Dados: M(SiO2) = 60 g mol-1 M(Na2SiO3) = 122 g mol-1
Considerando que o rendimento desse processo foi de 70%, a massa, em kg, de Na2SiO3 formada a partir de 9 kg de sílica foi de aproximadamente
A reação (não balanceada) dos íons permanganato com íons iodeto em meio alcalino pode ser representada por:
I-(aq) + MnO4-(aq) + H2O I2(aq) + MnO2(s) + OH-(aq)
Uma vez balanceada, a soma dos menores coeficientes estequiométricos inteiros dos reagentes é:
Em uma reação entre ácido sulfúrico e hidróxido de sódio, foram misturados 122,5g de ácido sulfúrico e 130g de NaOH. Segue a equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(s) + H2O(I)
• Qual o reagente limitante e a massa de NaOH consumida,
respectivamente?
NaN3 (s) → N2 (g) + Na (s)
Quando se acertam os coeficientes estequiométricos, usando o menor conjunto adequado de coeficientes inteiros, a soma dos coeficientes é
NH2Cl + NH3 → N2H4 + HCl
Assinale a alternativa que apresenta a massa de hidrazina que pode ser obtida pela reação de 10,0 g de cloramina com 10,0 g de amônia.
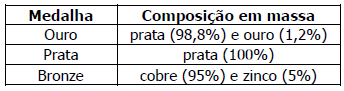
Considerando que as três medalhas tenham a mesma massa, assinale a alternativa que apresenta as medalhas em ordem crescente de número de átomos metálicos na sua composição.
Tabela 1: Composição química de uma água mineral
Composição química mg/L
Bicarbonato 82,7 Cálcio 16,0 Cloreto 1,1 Fluoreto 0,1 Magnésio 0,2 Potássio 0,3 Sódio 15,2
