Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 873 questões
Na2CO3 + HCℓ
 NaCl + CO2 + H2O
NaCl + CO2 + H2O
A massa, em gramas, de carbonato de sódio que reage completamente com 0,25 mols de ácido clorídrico é:
ΔH de formação do CO2 = - 94,1 kcal ΔH de formação do H2O = - 68,3 kcal ΔH de formação do etanol (C2H6O) = - 66,1 kcal.
A quantidade de calor (em kcal) desprendida na reação de combustão completa de 0,5 mol de etanol (C2H6O), é:
CHCl3(g) + Cl2(g)
 CCl4(g) + HCl(g)
CCl4(g) + HCl(g)
Considerando reagir 11,9 g de CHCl3 em um ambiente contendo gás cloro em excesso, qual a massa aproximada, em gramas, de HCl(g) produzida se a reação apresentar 75 % de rendimento?
O alumínio é obtido pela eletrólise da bauxita. Nessa eletrólise, ocorre a formação de oxigênio que reage com um dos eletrodos de carbono utilizados no processo. A equação não balanceada que representa o processo global é:
Al2O3 + C
 CO2 + Al
CO2 + Al Para 2 mols de Al2O3, quantos mols de CO2 e Al, respectivamente, são produzidos nesse processo?
Considerando a reação entre o gás carbônico e a água dentro dos vegetais tem-se a produção de glicose e gás oxigênio.
Reagindo 154 g de gás carbônico com 72 g de água, espera-se a formação de 96 g de gás oxigênio. Assinale a alternativa que compromete tal afirmação.
Considerando a reação entre o gás carbônico e a água dentro dos vegetais tem-se a produção de glicose e gás oxigênio.
Indique a quantidade do volume molar, em L, de glicose ao ser produzido 6 mols de gás oxigênio, tendo o volume molar igual a 22,4 L.
Sabe-se que sua massa molar é 192 g mo1-1 e que a sua composição percentual em massa é de 37,5% de carbono, 58,3% de oxigênio e o restante de hidrogênio. Sua fórmula molecular é, portanto,

O volume de gases do efeito estufa, gerado pela decomposição anaeróbica de 0,9 kg de glicose nas CNTP (O °c e 1 atm), será de aproximadamente
Em um processo de produção industrial, ao adicionar 254 kg de I2 e 80 kg de N2 H4 , verifica-se o consumo completo do reagente limitante. A massa de reagente em excesso, que não foi consumida, em quilogramas, tem valor igual a:
Fe2O3(s) + 3 H2S(g) → Fe2S3(s) + 3 H2O(l)
A partir desses dados, pode-se afirmar que, na condição de remoção máxima de sulfeto de hidrogênio relatada no estudo,
Massas molares (g mol-1): Fe = 56, H = 1, O = 16 e S = 32.
Dados: 1.000 gramas de etanol combustível apresentam 940 g de etanol e 60 g de água; massas molares (g mol-1): C2H6O = 46; CO2 = 44.
Um paciente, com recomendação médica para lúpus eritematoso, fez uso da hidroxicloroquina, ingerindo uma dose diária de 400 mg durante 4 semanas.
Afórmula deste composto é dada a seguir.
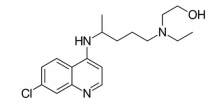
A quantidade de matéria , em mol, de hidroxicloroquina, ingerida pelo paciente ao longo das 4 semanas de tratamento foi de:
(Dado: massa molar da hidroxicloroquina = 335,5
g/mol)
3 Mn3O4 + 8 Al -> 9 Mn + 4 Al2O3
Em uma operação industrial, reagiu-se 13740 kg de Mn3O4 e 6480 kg de Al. Admitindo-se o consumo do reagente limitante por completo, a massa de Mn formado, em quilogramas, é igual a:
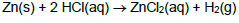
Se 10,00 g de Zn foram misturados com 8,00 g de ácido clorídrico, quantos mols de H2 foram liberados aproximadamente:
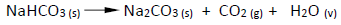
A termólise de 84 g do reagente produzirá a massa de carbonato de sódio e o número de mols de dióxido de carbono iguais a, respectivamente,
Para demonstrar a aplicação dessas leis, um professor apresentou uma reação do tipo A + B → C + D e solicitou aos alunos que encontrassem os valores que deveriam substituir as letras x, y e z na tabela.
REAÇÃO A B C D 1º experimento 12 g 25 g x 17 g 2º experimento 30 g y 50 g z
Baseando-se nas leis mencionadas, os valores corretos obtidos pelos alunos foram
Dados: Volume Molar (CATP) = 25 L; d(C8H18) = 800 g/L; Massas Molares – H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
Al + Fe2O3 → Fe + Al2O3
Dados: Massas Molares – O = 16 g/mol; Al = 27 g/mol; Fe = 56 g/mol