Questões de Vestibular de Química - Sistemas Gasosos - Lei, Teoria Cinética, Equação e Mistura dos Gases. Princípio de Avogadro.
Foram encontradas 53 questões
Considerando-se desprezível o volume do tubo de comunicação e sabendo-se que o volume do balão A é igual a 4.1 L e que a temperatura foi mantida em 27 ºC durante todo processo, o volume do balão B corresponde a:
Um laboratório de controle ambiental recebeu para análise uma amostra de gás sem identificação. Após algumas medidas, foram obtidos os seguintes dados:
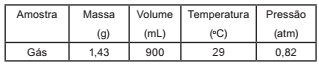
Com base nos valores obtidos, entre os gases indicados
nas opções, conclui-se que a amostra era de:
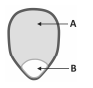
Um grão de milho de pipoca, visto a olho nu, apresenta duas regiões distintas, representadas por A e B na figura. Em A, ocorre o tecido acumulador de amido, usado, pela planta, para nutrir o embrião. Em B, os tecidos vegetais possuem maior teor de água.
Ao ser aquecida, parte da água transforma‐se em vapor, aumentando a pressão interna do grão. Quando a temperatura atinge 177°C, a pressão se torna suficiente para romper o grão, que vira uma pipoca.
Um estudo feito por um grupo de pesquisadores determinou que o interior do grão tem 4,5 mg de água da qual, no momento imediatamente anterior ao seu rompimento, apenas 9% está na fase vapor, atuando como um gás ideal e ocupando 0,1 mL. Dessa forma, foi possível calcular a pressão Pfinal no momento imediatamente anterior ao rompimento do grão.
A associação correta entre região do milho e Pfinal é dada por:
Note e adote:
Constante universal dos gases: R = 0,082 L.atm/(K.mol); K = °C + 273;
Massas molares (g/mol): H = 1; O = 16.
O Halotano, C2HBrClF3 , é um gás não inflamável, não explosivo, e não irritante que é geralmente usado como anestésico, por inalação. Suponha que se faça a mistura de 15.0 g de vapor de Halotano com 23.5 g do gás oxigênio sendo que a pressão total da mistura seja igual a 855 mmHg.
Nas condições apresentadas as pressões parciais do halotano e do oxigênio na mistura serão, respectivamente:
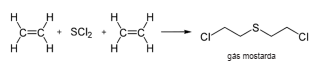
A partir da reação abaixo o volume aproximado, em metros cúbicos de etileno (d=1.18 kg/m3 ), necessário para preparar 2.0 toneladas de gás mostarda é:
Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr, quanto composições de CO2 e O2 em proporções adequadas. As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com
Admita que, imediatamente após a colocação do gás argônio em uma embalagem específica, esse gás assume o comportamento de um gás ideal e apresenta as seguintes características:
Pressão = 1 atm
Temperatura = 300 K
Massa = 0,16 g
Nessas condições, o volume, em mililitros, ocupado pelo gás na embalagem é:
Quatro balões esféricos são preenchidos isotermicamente com igual número de mols de um gás ideal. A temperatura do gás é a mesma nos balões, que apresentam as seguintes medidas de raio:
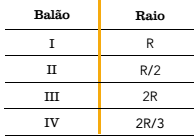
A pressão do gás é maior no balão de número:
Note e adote: Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
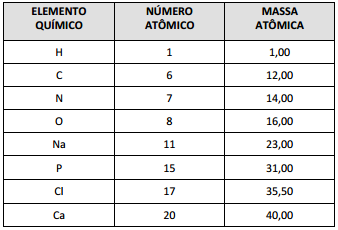
DADOS QUE PODEM SER USADOS NESTA PROVA
Para descrever o comportamento dos gases ideais em função do volume V, da pressão P e da temperatura T, podem ser utilizadas as seguintes equações:
Equação de Clapeyron Equação de Boltzmann
P × V = n × R × T P × V = N × k × T
n – número de mols N – número de moléculas
R – constante dos gases k – constante de Boltzmann
De acordo com essas equações, a razão R/k é aproximadamente igual a:
Note e adote: Volume molar nas condições de produção de biogás: 24 L/mol; energia liberada na combustão completa da gasolina: 4,5 x 104 kJ/L.
Dados: Equação da reação: ½ N2 + O2 → NO2
Massas molares em g mol-1: N2=28 , O2=32 e NO2= 46
