Questões de Vestibular
Sobre sistemas heterogêneos: produto de solubilidade (kps). em química
Foram encontradas 43 questões
O pH de uma solução que contém um precipitado de Cr(OH)3 (Kps = 6.0 x 10-11 a uma dada temperatura) deve ser ajustado de modo que todo o precipitado se dissolva, produzindo uma solução na qual a [Cr3+] seja 0.1 mol/L.
Nesse caso, o valor do pH é de, aproximadamente:
Dado: Kw = 1.0x 10-14
Cálculos renais, conhecidos popularmente por “pedras nos rins”, consistem principalmente em oxalato de cálcio, CaC2O4, espécie cuja constante de solubilidade (Kps) é de aproximadamente 2 × 10−9 . Os íons oxalato, presentes em muitos vegetais, reagem com os íons cálcio para formar oxalato de cálcio, que pode gradualmente se acumular nos rins. Supondo que a concentração de íons cálcio no plasma sanguíneo seja de cerca de 5 × 10−3 mol/L, qual seria a concentração mínima, em mol/L, de íons oxalato para que CaC2O4 precipitasse?
Note e adote:
Desconsidere a presença de quaisquer
outros íons e considere que a
concentração no plasma é determinante
para a precipitação do oxalato.
Considere um frasco de contraste contendo 100 mL de suspensão de sulfato de bário na presença de sulfato de potássio 0,01 mol.L-1. A massa de bário presente na forma de íons Ba2+ na suspensão está na ordem de:
Em relação a uma solução aquosa saturada desse sal, contendo uma certa quantidade de sal sólido, não dissolvido, são feitas as seguintes afirmações.
I - A adição de nitrato de bário diminui a quantidade de sólido não dissolvido. II - A adição de sulfato de sódio aumenta a quantidade de sólido não dissolvido. III - Uma reação reversível, na qual a dissolução do sal é exatamente contrabalançada pela sua precipitação, é estabelecida nessa situação.
Quais estão corretas?
A solubilidade, a 25 o C, do hidróxido de estrôncio é de 4,0 g por 1 L de água.
A partir dessa informação, o produto de solubilidade do Sr(OH)2 é
Dado
M Sr(OH)2
= 122 g mol-1
PbCO3(s) ⥋ Pb2 +(aq) + CO3 2 –(aq)
A concentração de íons carbonato, presentes nesse equilíbrio, é
Dado: Produto de Solubilidade do PbCO3, a 25 °C: Kps = 7,4 · 10–14
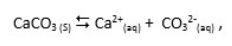
onde Kps é a constante do produto de solubilidade
A afirmação incorreta encontra-se na afirmativa
Conforme o equilíbrio químico abaixo, considere a solução saturada de dissolução do calcário na água, a afirmação incorreta é
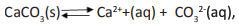
sendo que Kps é a constante do produto de
solubilidade,a afirmação incorreta é:
Ca(OH)2 (s)
 Ca2+ (aq) + 2OH– (aq)
Ca2+ (aq) + 2OH– (aq)
A constante desse equilíbrio, também conhecida como Kps, é calculada pela expressão
Sabendo que o produto de solubilidade do sulfato de bário, BaSO4, é definido por
BaSO4(s)
 Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10
Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10
calcule a solubilidade molar deste sal.
FIGURA 03
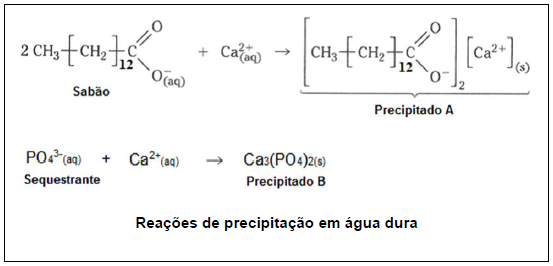
De acordo com as informações anteriores, pode-se inferir que o sequestrante contribui para diminuir o problema dos sabões em água dura, porque:
Acerca do oxalato de cálcio, assinale a alternativa incorreta.
PbSO4(s)
 Pb2+
(aq) + SO4
2- (aq) ; Kps
= 2 × 10-8
(mol L-1
)
2
Pb2+
(aq) + SO4
2- (aq) ; Kps
= 2 × 10-8
(mol L-1
)
2
A concentração mínima, em mol L-1 , de íons SO4 2- que deve ser mantida em solução para que tal diminuição ocorra é
Foram preparadas misturas de acordo com a descrição a seguir:
I: 100 mL de H2O e 4,9 g de H2SO4
II: 100 mL de H2O e 4,48 g de KOH
III: 100 mL de H2O e 0,5 g de AgOH
Dado: KpS AgOH = 10-8
Todas as afirmativas são verdadeiras, EXCETO:
Em água, o produto de solubilidade do AgCl é calculado a partir do equilíbrio indicado na Equação I. Em meio aquoso
contendo concentração elevada de amoníaco, forma-se a espécie Ag(NH3
)2+, conforme a Equação II.
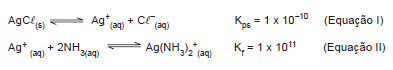
Num sistema aquoso contendo AgCl(s) e NH3
, tem-se
