Questões de Vestibular de Química - Sistemas Heterogêneos: Produto de Solubilidade (Kps).
Foram encontradas 43 questões
O medicamento utilizado para destacar órgãos em exames radiológicos pode ter causado a morte de pelo menos 21 pessoas no país. Sua matéria-prima é o sulfato de bário. Análise preliminar da Fiocruz (Fundação Oswaldo Cruz) apontou a presença de carbonato de bário em um lote do produto distribuído por determinado laboratório. O carbonato de bário é utilizado em venenos para rato. Pacientes tomam sulfato de bário para que os órgãos de seu sistema digestório fiquem visíveis nas radiografias. É o chamado contraste.
Considere que o Ks do sulfato de bário é 1 x 10-10 .
O sulfato de bário é administrado na forma de uma suspensão.
Disponível em: <http://www1.folha.uol.com.br/folha/cotidiano/ult95u76538.shtml> Acesso em: 10 ago. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Se for adicionada à suspensão de sulfato de bário uma solução de sulfato de potássio, o teor
de bário livre deve aumentar.
O medicamento utilizado para destacar órgãos em exames radiológicos pode ter causado a morte de pelo menos 21 pessoas no país. Sua matéria-prima é o sulfato de bário. Análise preliminar da Fiocruz (Fundação Oswaldo Cruz) apontou a presença de carbonato de bário em um lote do produto distribuído por determinado laboratório. O carbonato de bário é utilizado em venenos para rato. Pacientes tomam sulfato de bário para que os órgãos de seu sistema digestório fiquem visíveis nas radiografias. É o chamado contraste.
Considere que o Ks do sulfato de bário é 1 x 10-10 .
O sulfato de bário é administrado na forma de uma suspensão.
Disponível em: <http://www1.folha.uol.com.br/folha/cotidiano/ult95u76538.shtml> Acesso em: 10 ago. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Uma suspensão de sulfato de bário deve conter cerca de 0,00137 g de bário dissolvido.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
FIGURA 03
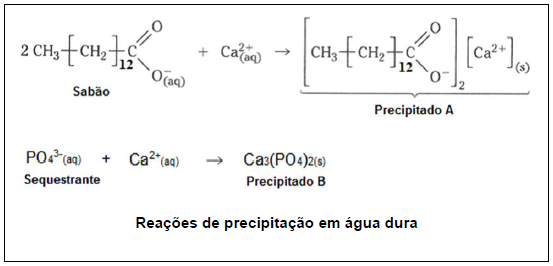
De acordo com as informações anteriores, pode-se inferir que o sequestrante contribui para diminuir o problema dos sabões em água dura, porque:
Foram preparadas misturas de acordo com a descrição a seguir:
I: 100 mL de H2O e 4,9 g de H2SO4
II: 100 mL de H2O e 4,48 g de KOH
III: 100 mL de H2O e 0,5 g de AgOH
Dado: KpS AgOH = 10-8
Todas as afirmativas são verdadeiras, EXCETO:
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
Para obtermos 100 mL de uma solução aquosa saturada de hidróxido de cálcio, Ca(OH)2, para o experimento, devemos levar em consideração a solubilidade desse composto.
Sabendo que o produto de solubilidade do hidróxido de cálcio é 5,5 x 10-6, a 25 °C, a solubilidade dessa base em mol/L é, aproximadamente,
Dados:
Ca(OH)2(s) ⇌ Ca2+(aq) + 2OH–(aq)
Kps = [Ca2+] . [OH–]
2
Acerca do oxalato de cálcio, assinale a alternativa incorreta.
Com o desenvolvimento da fotografia nos séculos XIX e XX, muitos estudos investigaram a química dos haletos de prata. Com isso, além do desenvolvimento tecnológico, avanços científicos foram alcançados no entendimento da formação de cristais e reações fotoquímicas envolvendo compostos iônicos. Na tabela a seguir são fornecidos dados de propriedades, como produto de solubilidade e de potencial padrão de redução, dos principais haletos de prata.
KPS (mol2 . dm-6) E0 (V)
AgX + e- → Ag0 + X-
AgCℓ 1,77 x 10-10 0,22233
AgBr 5,35 x 10-13 0,07133
Agl 8,52 x 10-17 -0,15224
Com relação aos haletos de prata, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) O cátion Ag+ possui maior afinidade por haletos de mais baixa razão carga:raio.
( ) Existe uma tendência clara: quanto menos solúvel é o haleto de prata, menos oxidante esse composto será.
( ) Numa amostra composta por uma mistura de cloreto, brometo e iodeto de prata, e um forte agente redutor, a primeira espécie a reduzir será o Agl.
( ) Ao se adicionar 1 mol de um haleto de prata sólido (representação genérica: AgX) numa solução aquosa 1,0 mol.dm-3 do respectivo haleto de potássio (representação genérica: KX), a máxima quantidade de íons prata em solução será inferior a ppb (partes por bilhão).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
PbSO4(s)
 Pb2+
(aq) + SO4
2- (aq) ; Kps
= 2 × 10-8
(mol L-1
)
2
Pb2+
(aq) + SO4
2- (aq) ; Kps
= 2 × 10-8
(mol L-1
)
2
A concentração mínima, em mol L-1 , de íons SO4 2- que deve ser mantida em solução para que tal diminuição ocorra é
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
O consumo dos íons carbonato em meio ácido aumenta a
solubilidade do CaCO3 e do Na2CO3, o que acelera a
degradação de monumentos, conforme mencionado no texto.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
A solubilidade do CaCO3 em água pura, a 25 ºC, é igual a
9,0 mg/L.
Em água, o produto de solubilidade do AgCl é calculado a partir do equilíbrio indicado na Equação I. Em meio aquoso
contendo concentração elevada de amoníaco, forma-se a espécie Ag(NH3
)2+, conforme a Equação II.
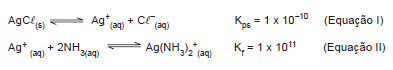
Num sistema aquoso contendo AgCl(s) e NH3
, tem-se
Em água, o produto de solubilidade do AgCl é calculado a partir do equilíbrio indicado na Equação I. Em meio aquoso contendo concentração elevada de amoníaco, forma-se a espécie Ag(NH3)2 +, conforme a Equação II.
AgCl(s)  Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+
(aq) + 2NH3(aq)  Ag(NH3)2
+
(aq) Kf
= 1 x 1011 (Equação II)
Ag(NH3)2
+
(aq) Kf
= 1 x 1011 (Equação II)
Num sistema aquoso contendo AgCl(s) e NH3
, tem-se
 Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+
(aq) + 2NH3(aq)
Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+
(aq) + 2NH3(aq)  Ag(NH3)2+(aq) Kf
= 1 x 1011 (Equação II)
Ag(NH3)2+(aq) Kf
= 1 x 1011 (Equação II) Num sistema aquoso contendo AgC(s) e NH3 , tem-se
A solubilidade desse composto a 25.0°C, em água pura e em uma solução de pH igual a 13.00, será, respectivamente, em molL-1 :
Carbonato de cobalto é um sal muito pouco solúvel em água e, quando saturado na presença de corpo de fundo, a fase sólida se encontra em equilíbrio com os seus íons no meio aquoso.
CoCO3(s) ⇌ Co2+(aq) + CO32-(aq)
Sendo o produto de solubilidade do carbonato de cobalto, a 25 oC, igual a 1,0 x 10-10, a solubilidade do sal, em mol L-1, nessa temperatura é