Questões de Vestibular
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 74 questões
O pH de uma solução que contém um precipitado de Cr(OH)3 (Kps = 6.0 x 10-11 a uma dada temperatura) deve ser ajustado de modo que todo o precipitado se dissolva, produzindo uma solução na qual a [Cr3+] seja 0.1 mol/L.
Nesse caso, o valor do pH é de, aproximadamente:
Dado: Kw = 1.0x 10-14
O hidróxido de alumínio (Al(OH)3), ao precipitar em solução aquosa, forma um sólido gelatinoso que pode ser usado como agente floculante no tratamento de água. Essa precipitação pode ocorrer pela adição de um hidróxido solúvel a uma solução aquosa ácida contendo um sal de alumínio solúvel, como o AlCl3. Entretanto, adicionando-se excesso de hidróxido ao meio, há a formação de íons Al(OH)4− , espécie solúvel em água, e o precipitado se solubiliza novamente. Dessa forma, dependendo do pH do meio, uma dentre as espécies Al(OH)4 −(aq), Al(OH)3(s) e Al 3+(aq) estará presente na solução em quantidade maior que as demais, como exemplificado no esquema.
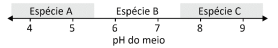
A alternativa que mostra corretamente qual das espécies estará
em quantidade maior que as duas outras em cada faixa de pH é:
DADOS QUE PODEM SER USADOS NESTA PROVA

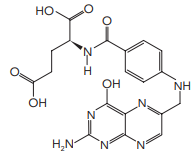
Considere um dado valor de pH, para o qual apenas os hidrogênios das carboxilas do ácido fólico se ionizam. Nessa situação, a carga do ânion formado é igual a:
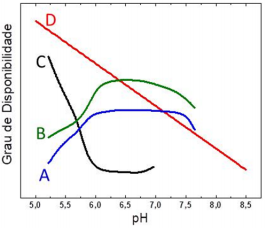
Considerando essas informações e os conhecimentos de química, é correto afirmar que a calagem atua em solos

Um aluno do curso de química em uma aula prática de Química Geral, precisa preparar uma solução de hidróxido de potássio de pH = 12 a 25ºC. qual a massa de KOH que ele precisa dissolver em 200 mL de água para obter o pH desejado?
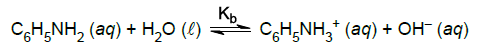
Sabe-se que Kb ≈ 4 × 10–10 a 25 ºC e que o valor de pH de uma solução aquosa saturada de anilina a 25 ºC é próximo de 9. Com base nessas informações e sabendo que Kw nessa temperatura é igual a 1 × 10–14, a concentração aproximada da solução saturada de anilina a 25 ºC é
Uma amostra de água mineral natural a 25 °C foi testada com três indicadores ácido-base. Os resultados desse teste estão indicados na última coluna da tabela.

Analisando as informações da tabela e sabendo que o
produto iônico da água a 25 °C, Kw, é igual a 1 × 10−14, a
concentração de íons OH− (aq) nessa água mineral, em
mol/L, está entre
Considerando-se que a 25 °C o produto iônico da água (Kw) é igual a 1 × 10–14, as quantidades de íons H+ e de íons OH– presentes nessa garrafa de água são, respectivamente,
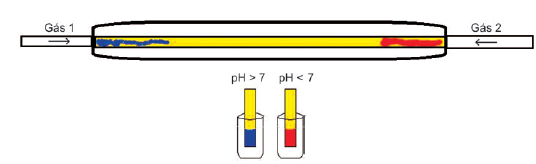
Os gases 1 e 2 empregados no experimento podem ser, respectivamente,
Considere que uma colher de sopa de vinagre com um teor de ácido acético de 3,0 % (m/v) foi misturada com 4 colheres de sopa de água para ser usada em limpeza. O valor de pH do vinagre após a diluição é de:
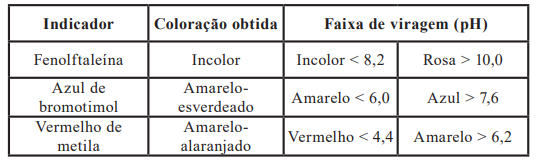
De acordo com o resultado obtido experimentalmente, pode-se seguramente afirmar que a faixa de pOH da amostra desconhecida, de acordo com a coloração obtida, encontra-se entre

A esses frascos foi adicionado extrato de repolho roxo, um indicador ácido-base. Em meio muito ácido, esse extrato adquire coloração vermelha; em meio moderadamente ácido, rosa; e em meio básico, verde.
As colorações dos líquidos contidos nesses frascos, respectivamente, após a adição do extrato são:
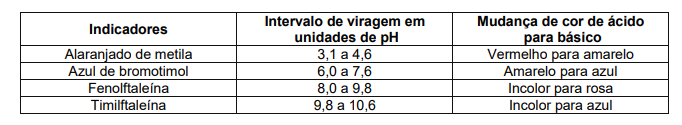
Para diferenciar-se uma solução de pH=5,0 de uma solução de pH=8,0, ambas incolores, deve-se usar o indicador
Um estudante de Engenharia Química pipeta 50mL de solução aquosa 0,02mol/L de ácido clorídrico e transfere para um balão volumétrico de 1000mL, ajustando-se para esse volume a solução final, usando água pura.
O pH da solução final é igual a
Considerando log2 = 0,3, ao adicionar água destilada a 10 mL de suco de abacaxi concentrado, até atingir o volume de 500 mL, o pH dessa solução será igual a

Completam as lacunas do texto, respectivamente,
