Questões de Vestibular
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 71 questões
Dado log de 2 = 0,3

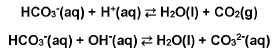
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:
As antocianinas existem em plantas superiores e são responsáveis pelas tonalidades vermelhas e azuis das flores e frutos. Esses corantes naturais apresentam estruturas diferentes conforme o pH do meio, o que resulta em cores diferentes.
O cátion flavílio, por exemplo, é uma antocianina que apresenta cor vermelha e é estável em pH ≈ 1. Se juntarmos uma solução dessa antocianina a uma base, de modo a ter pH por volta de 5, veremos, durante a mistura, uma bonita cor azul, que não é estável e logo desaparece.
Verificou-se que a adição de base a uma solução do cátion flavílio com pH ≈ 1 dá origem a uma cinética com 3 etapas de tempos muito diferentes. A primeira etapa consiste na observação da cor azul, que ocorre durante o tempo de mistura da base. A seguir, na escala de minutos, ocorre outra reação, correspondendo ao desaparecimento da cor azul e, finalmente, uma terceira que, em horas, dá origem a pequenas variações no espectro de absorção, principalmente na zona do ultravioleta.
(Paulo J. F. Cameira dos Santos et al. “Sobre a cor dos vinhos:
o estudo das antocianinas e compostos análogos não parou
nos anos 80 do século passado”. www.iniav.pt, 2018. Adaptado.)
A variação de pH de ≈1 para ≈5 significa que a concentração de íons H+ (aq) na solução ________ , aproximadamente, _______vezes. Entre as etapas cinéticas citadas no texto, a que deve ter maior energia de ativação e,
portanto, ser a etapa determinante da rapidez do processo
como um todo é a _________.
As lacunas do texto são preenchidas, respectivamente, por:
Temperatura (°C) Kw pH 0 1,14 × 10–15 7,47 10 2,95 × 10–15 7,27 20 1,00 × 10–14 7,00 30 1,47 × 10–14 6,83 50 5,30 × 10–14 6,27
Analisando-se os dados, pode-se afirmar, corretamente, que a
Sabe-se pKa = - logKa = 7.20, em que Ka é a constante de dissociação do H2 PO4 - em água a 25 ºC.
O pH da primeira solução e a relação do pH da segunda solução com o pH da primeira são, respectivamente:
Cada estudante recebeu um recipiente contendo 800 mL de água destilada com algumas gotas do indicador de pH alaranjado de metila e soluções de HCl e NaOH em diversas concentrações.
Cada estudante deveria jogar apenas uma vez dois dados, um amarelo e um vermelho, ambos contendo os números de 1 a 6.
• Ao jogar o dado vermelho, o estudante deveria adicionar ao recipiente 100 mL de solução do ácido clorídrico na concentração 10−n mol/L,sendo n o número marcado no dado (por exemplo, se saísse o número 1 no dado, a solução seria de 10−1 mol/L; se saísse 6, a solução seria de 10−6 mol/L). • Ao jogar o dado amarelo, o estudante deveria executar o mesmo procedimento, mas substituindo o ácido por NaOH, totalizando assim 1,0 L de solução. • O estudante deveria observar a cor da solução ao final do experimento.
A professora mostrou a tabela com alguns valores de pH resultantes conforme os números tirados nos dados. Ela pediu, então, aos estudantes que utilizassem seus conhecimentos e a tabela para prever em quais combinações de dados a cor final do indicador seria vermelha.
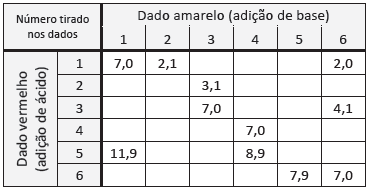
A probabilidade de, após realizar o procedimento descrito, a solução final preparada por um estudante ser vermelha é de:
Note e adote:
Considere a seguinte relação entre pH do meio e coloração do indicador alaranjado de metila:
Menor que 3,3 3,3 a 4,4 Maior que 4,4 Vermelho Laranja Amarelo
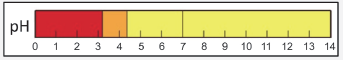
O leite “talhado” é o resultado da precipitação das proteínas do leite (caseína), quando o seu pH for igual ou menor que 4,7.
Qual das soluções abaixo levaria o leite a talhar?
Tem-se uma solução de hidróxido de amônio (Kb = 1.7x10-5) que apresenta um pH igual a 10.00.
A molaridade desta solução é:
A desomorfina, assim como a morfina e a heroína, é um derivado do ópio. Usada para fins medicinais na terapia da dor crônica e aguda de alta intensidade, a desomorfina produz fortes ações de insensibilidade à dor. A ingestão de doses elevadas da substância causa euforia, estados hipnóticos e dependência. A desomorfina é de 8 a 10 vezes mais potente que a morfina, tratando-se de um opiáceo sintético com estrutura quase idêntica à da heroína, mas muito mais barata.
Supondo que, a 25 °C, a desomorfina tenha um pKa de 9,69, a morfina tenha um pKa de 8,21 e a heroína tenha um pKa de 7,60, tem-se que a
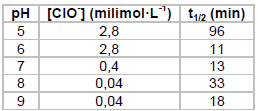
Sendo t1/2 o tempo para a concentração do sarin cair à metade, de acordo com a tabela a reação é mais rápida em
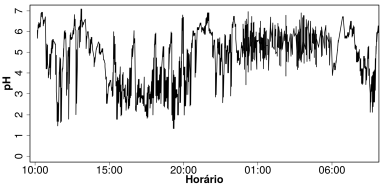
Dados: O pH normal no esôfago mantém-se em torno de 4 e o pH da saliva entre 6,8-7,2.
Assim, episódios de refluxo gastroesofágico acontecem quando o valor de pH medido é
O ácido láctico é um composto orgânico de função mista que apresenta fórmula CH3 CH(OH)COOH. O organismo humano produz ácido láctico em quantidades expressivas durante a realização de exercícios físicos, sendo produzido excessivamente quando esses se intensificam. No ambiente celular, o ácido láctico transforma-se em lactato, que é a sua forma ionizada. A mistura de ácido láctico e lactato de sódio, em solução aquosa, funciona como uma solução-tampão, ou seja, como, praticamente, aquela que não muda seu pH pela adição de H+ ou OH- em pequenas quantidades.
Supondo uma solução contendo 0.15 mol/L de ácido láctico e 0.15 mol/L de lactato de sódio (Ka = 1.0 x 10-4) e negligenciando a quantidade de ácido que ioniza, o valor do pH será igual a :
Amplamente comercializado, em todo o Brasil, sobretudo por seu valor energético, o açaí contém antocianinas, substâncias responsáveis pelas colorações nos tons de azul, vermelho e arroxeado em diversos tecidos vegetais, especialmente em flores e frutos. As antocianinas mudam sua coloração conforme a acidez ou basicidade do meio em que se encontram. Isso faz com que o extrato de açaí possa atuar como um indicador ácido-base. O extrato de açaí, por exemplo, torna-se avermelhado em soluções ácidas (pH<7), esverdeado em soluções básicas (pH>7) e roxo claro em soluções neutras (pH=7).
Observando a figura abaixo, as substâncias que, em presença de extrato de açaí, apresentariam, respectivamente, colorações avermelhadas, esverdeadas e arroxeadas são:

A calcinação de 2.8400 g de uma mistura sólida constituída de CaCO3 e MgCO3 produziu um gás e um resíduo sólido de peso 1.5200 g.
Com essas informações, é correto afirmar que
Para sua apresentação em um “show de química”, um grupo de estudantes confeccionou um recipiente com três compartimentos, 1, 2 e 3, dispostos de modo a lembrar o formato da bandeira brasileira. A esses compartimentos, adicionaram três soluções aquosas diferentes, todas incolores e de concentração igual a 0,1 mol/L, uma em cada compartimento. O recipiente foi mantido em posição horizontal.
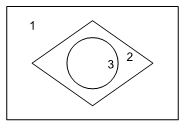
Em seguida, acrescentaram em cada compartimento o indicador azul de bromotimol, que apresenta cor azul em pH > 7,6 e amarela em pH < 6,0. Como resultado, o recipiente apresentou as cores da bandeira nacional, conforme mostra a figura.
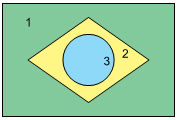
As soluções aquosas colocadas inicialmente pelos estudantes
nos compartimentos 1, 2 e 3 podem ter sido, respectivamente,
