Questões de Vestibular
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 71 questões

Os indicadores ácido-base são substâncias químicas que, em solução aquosa, têm a propriedade de mudar de cor, na presença de íons H+ (aq) ou íon OH- (aq) e identificar se uma solução aquosa é ácida ou básica, a exemplo de fenolftaleína e de tornassol, representados na tabela.
Considerando-se as informações do texto e os dados da tabela, é correto afirmar:

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
Caso pKa = - log Ka , em que Ka é a constante de dissociação ácida do AAS, seja igual a 3,5, então a aspirina será mais bem absorvida pelo epitélio do estômago, onde o pH médio é 2, que pelo duodeno, onde o pH médio é 8.
Sabe-se que o pH de alvejantes formados por soluções aquosas de hipoclorito de sódio é superior a 7. Isso se deve ao fato de o NaClO, ao reagir com a água, produzir o ácido hipocloroso (HClO), o que aumenta a razão [OH- ]/[H3O+ ] no meio.
PbS (s) ⇄ Pb2- (aq) + S2- (aq) S2- (aq) + 2 H- (aq)⇄ H2S (aq)
Neste gráfico, estão representadas as concentrações de Pb 2+ e S 2– , originadas exclusivamente do PbS, em função do pH da água:
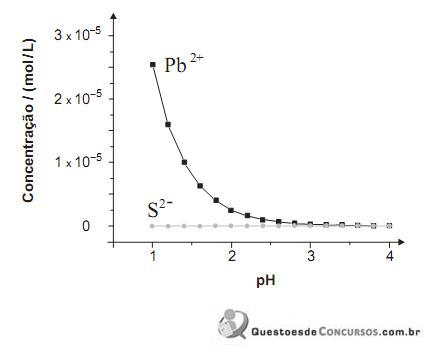
Considere que a incidência de chuva ácida sobre o mesmo lago altera a concentração das espécies envolvidas nos dois equilíbrios.
Com base nessas informações, é CORRETO afirmar que, na situação descrita,
Nos três casos, ocorreu reação química e observou-se a formação de bolhas.
Ao final das reações, as três soluções tornaram-se cor-de-rosa.
O tempo necessário para que cada uma dessas reações se complete está registrado neste quadro:
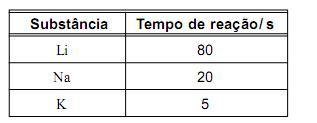
Considerando-se essas informações, é INCORRETO afirmar que
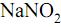 é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.
é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.Dada a constante de hidrólise:
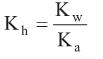
e considerando as constantes de equilíbrio
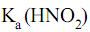 = 5 × 10–4 e
= 5 × 10–4 e 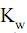 = 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual a
= 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual a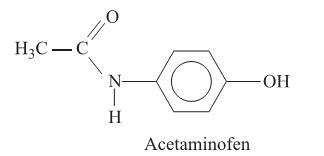
Considere a figura com a estrutura do acetaminofen e as seguintes afirmações:
I. O acetaminofen apresenta fórmula molecular
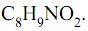
II. O grupo funcional amida é que confere o caráter básico do acetaminofen.
III. A absorção do ácido acetilsalicílico em um indivíduo é maior no estômago do que no intestino, devido ao baixo pH do suco gástrico.
IV. Os fenóis apresentam menor acidez do que os ácidos carboxílicos.
São corretas as afirmações

