Questões de Vestibular
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 71 questões
Em uma aula de laboratório de química, foi realizado um experimento que consistiu em adicionar em um béquer 300 g de água, em temperatura ambiente, e certa quantidade do sal sulfato de magnésio hexaidratado (MgSO4 . 6H2O) até formar uma solução saturada com corpo de fundo. Essa mistura foi aquecida até completa solubilização do sal, que ocorreu quando a temperatura atingiu 50 ºC. Na sequência, deixou-se a solução resfriar até 20 ºC e verificou-se novamente a presença do sal cristalizado no fundo do béquer.
Foram fornecidos aos alunos os dados de solubilidade desse sal nas duas temperaturas medidas.
Com as informações fornecidas, foram calculadas as massas do sal presente na solução a 50 ºC e do sal cristalizado
a 20 ºC. Esses resultados são corretamente apresentados,
nessa ordem, em:
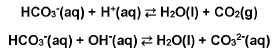
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:
Qual das substâncias acima é a adequada para se preparar a solução de preenchimento desse tipo de extintor?
Os fertilizantes utilizados na reposição dos elementos químicos indispensáveis para o desenvolvimento dos vegetais são constituídos por sais inorgânicos, como o nitrato de potássio, KNO3(s), hidrogeno-fosfato de cálcio, CaHPO4(s), cloreto de amônio, NH4Cl(s), dentre outros. Os nutrientes são absorvidos pelas raízes das plantas sob a forma de íons, obtidos pela dissolução dos sais na água retida no solo, e dependem do pH do ambiente.
Com base nas informações associadas às estruturas e às propriedades dos sais inorgânicos, é correto afirmar
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq) ⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
I. CaC2(s) + N2(g) 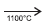 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
Com o desenvolvimento da fotografia nos séculos XIX e XX, muitos estudos investigaram a química dos haletos de prata. Com isso, além do desenvolvimento tecnológico, avanços científicos foram alcançados no entendimento da formação de cristais e reações fotoquímicas envolvendo compostos iônicos. Na tabela a seguir são fornecidos dados de propriedades, como produto de solubilidade e de potencial padrão de redução, dos principais haletos de prata.
KPS (mol2 . dm-6) E0 (V)
AgX + e- → Ag0 + X-
AgCℓ 1,77 x 10-10 0,22233
AgBr 5,35 x 10-13 0,07133
Agl 8,52 x 10-17 -0,15224
Com relação aos haletos de prata, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) O cátion Ag+ possui maior afinidade por haletos de mais baixa razão carga:raio.
( ) Existe uma tendência clara: quanto menos solúvel é o haleto de prata, menos oxidante esse composto será.
( ) Numa amostra composta por uma mistura de cloreto, brometo e iodeto de prata, e um forte agente redutor, a primeira espécie a reduzir será o Agl.
( ) Ao se adicionar 1 mol de um haleto de prata sólido (representação genérica: AgX) numa solução aquosa 1,0 mol.dm-3 do respectivo haleto de potássio (representação genérica: KX), a máxima quantidade de íons prata em solução será inferior a ppb (partes por bilhão).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
NH4OH(aq)
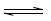 NH4+(aq) + OH-
(aq)
NH4+(aq) + OH-
(aq)
Adiciona-se 1 mL de solução aquosa de cloreto de amônio (NH4Cl),com concentração igual a 1 mol L-1 , a 100 mL da solução aquosa de concentração igual a 0,1 mol L -1 de hidróxido de amônio (NH4OH). Após a adição da solução salina, o pH da solução resultante, em relação ao pH da solução original de NH4OH, se torna
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
A solubilidade do CaCO3 em água pura, a 25 ºC, é igual a
9,0 mg/L.
Duas soluções nomeadas X e Y foram preparadas a 25 ºC com as características dadas na tabela a seguir:
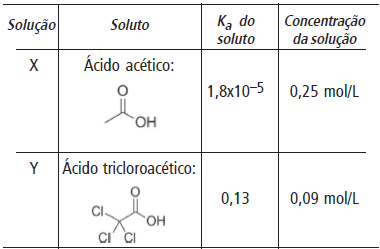
Considerando as informações fornecidas, analise os itens I a III.
I) A solução Y apresenta pH mais baixo que a solução X.
II) O ácido acético é mais fraco que o ácido tricloroacético.
III) A solução Y apresentará maior condutibilidade elétrica que a X.
Estão corretos os itens:
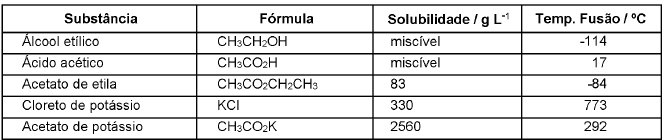
O soro caseiro, que serve para combater a desidratação causada por diarreia ou vômito, é uma solução aquosa contendo sal de cozinha (NaCl) e açúcar (C12H22O11). Ele pode ser feito misturando-se 3,5g de sal de cozinha e 20g de açúcar em 1L de água. Em relação ao soro caseiro, assinale a alternativa CORRETA:
Dados:
Coeficiente de Solubilidade do NaCl: 36g NaCl/100mL de água a 20°C; Coeficiente de Solubilidade do C12H22O11: 33g C12H22O11/100mL de água a 20°C.
O quadro fornece indicações sobre a solubilidade de alguns compostos iônicos inorgânicos em água a 20 ºC.
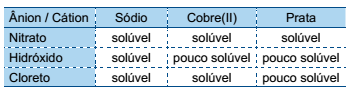
Em um laboratório, uma solução aquosa obtida a partir da
reação de uma liga metálica com ácido nítrico contém nitrato
de cobre(II) e nitrato de prata. Dessa solução, pretende-se
remover, por precipitação, íons de prata e íons de cobre(II),
separadamente. Para tanto, pode-se adicionar à mistura uma
solução aquosa de
Sob temperatura constante, acrescentou-se cloreto de sódio em água até sobrar sal sem se dissolver, como corpo de fundo. Estabeleceu-se assim o seguinte equilíbrio:
NaCℓ (s) ⇌ Na+ (aq) + Cℓ – (aq)
Mantendo a temperatura constante, foi acrescentada mais uma porção de NaCℓ (s). Com isso, observa-se que a condutibilidade elétrica da solução sobrenadante ________ , a quantidade de corpo de fundo _______________ e a concentração de íons em solução ________ .
As lacunas do texto devem ser preenchidas, respectivamente, por:
A mandioca, uma das principais fontes de carboidratos da alimentação brasileira, possui algumas variedades conhecidas popularmente como “mandioca brava”, devido a sua toxicidade. Essa toxicidade se deve à grande quantidade de cianeto de hidrogênio (HCN) liberado quando o tecido vegetal é rompido.
Após cada etapa do processamento para a produção de farinha de mandioca seca, representado pelo esquema a seguir, quantificouse o total de HCN nas amostras, conforme mostrado no gráfico que acompanha o esquema.
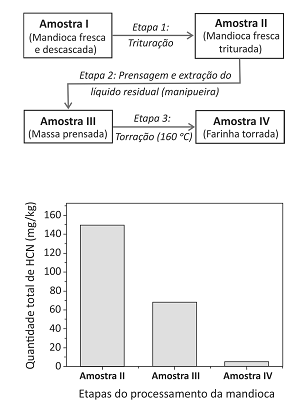
O que ocorre com o HCN nas Etapas 2 e 3?
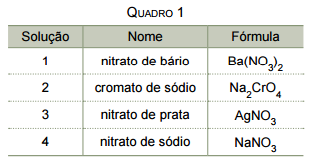
O quadro 2 apresenta o resultado das misturas, de volumes iguais, de cada duas dessas soluções.
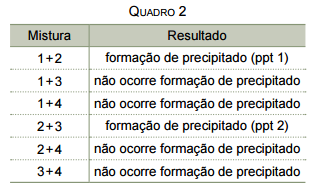
De acordo com essas informações, os precipitados formados, ppt 1 e ppt 2, são, respectivamente,