Questões de Vestibular
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 71 questões
Os efeitos tóxicos do dióxido de carbono exigem a sua remoção contínua de espaços fechados. A reação entre hidróxido de lítio e de dióxido de carbono é usada para remover o gás de naves espaciais e submarinos. O filtro utilizado nestes equipamentos é basicamente composto de hidróxido lítio. O ar seria direcionado para o filtro através de ventiladores, ao entrar em contato com o hidróxido de lítio presente nos filtros ocorre a reação com o dióxido de carbono existente no ar. A reação global é exotérmica, formando carbonato de lítio sólido e água no estado gasoso.
Disponível em: <http://www.abq.org.br/cbq/2014/trabalhos/14/4463-18723.html>.
Analisando o texto e a reação não balanceada, assinale a alternativa CORRETA.
CO2(g) + LiOH(s) → Li2CO3(s) + H2O(v)
Um estudante misturou 100 mL de solução de H2SO4 0,10 mol L-1 com 100 mL de solução aquosa de NaOH 0,050 mol L-1 .
Sobre a reação e seu resultado, obteve-se:
O nitrito de sódio, NaNO2 , é um conservante de alimentos processados a partir de carnes e peixes. Os dados de solubilidade deste sal em água são apresentados na tabela.

Em um frigorífico, preparou-se uma solução saturada de
NaNO2
em um tanque contendo 0,5 m3
de água a 50°C. Em
seguida, a solução foi resfriada para 20°C e mantida nessa
temperatura. A massa de NaNO2
, em kg, cristalizada após o
resfriamento da solução, é
Considere: Densidade da água = 1 g/mL
A titulação de 50 mL de uma solução aquosa de ácido clorídrico, com uma solução aquosa de hidróxido de sódio de concentração molar igual a 0,1 mol/L, utilizando fenolftaleína como indicador, está representada no gráfico a seguir.
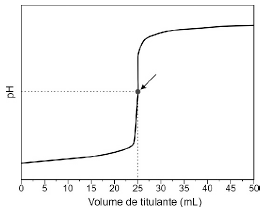
Considerando as informações do enunciado e do gráfico, assinale a alternativa correta.
Assinale a resposta que apresenta a pureza da amostra analisada.
Uma amostra dessa mistura gasosa, com volume total de 30 L, sob temperatura de 27 ºC e pressão de 1 atm, ao reagir com a solução aquosa de Ba(OH)2 , produz a precipitação de 98,5 g de BaCO3 . A fração gasosa remanescente, nas mesmas condições de temperatura e pressão, contém apenas CH4 .
Considere: M(Cu) = 63,5 g mol-1
M(S) = 32 g mol-1
Durante o verão, verificam-se habitualmente tempestades em muitas regiões do Brasil. São chuvas intensas e de curta duração, acompanhadas muitas vezes de raios. No litoral, essas tempestades constituem um risco para os banhistas, pois a água salgada é eletricamente condutora. Isso se explica pelo fato de a água salgada conter grande quantidade de _________, como Na+ e Cl−, livres para transportar carga elétrica no meio. Uma maneira de liberar essas partículas é dissolver sal de cozinha em um copo de água. Nesse processo, os _________ existentes no sal sofrem _________.
As expressões que completam corretamente o texto são, respectivamente:
O nitrato de potássio possui o seguinte gráfico de solubilidade (g/100 g de água) em função da temperatura:
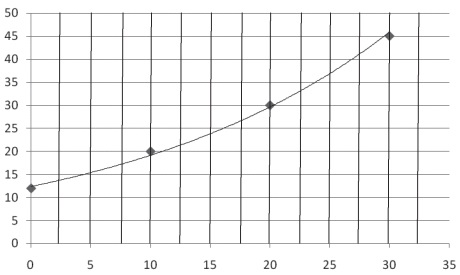
Considere uma solução saturada de KNO3 que contem, alem do sal, 500 g de H2O e está a 20ºC. Essa solução é resfriada sob agitação constante a 10ºC. Da analise da curva de solubilidade, podemos concluir que
Tubo A: 10 mL de solução de hidróxido de cálcio
Tubo B: 10 mL de solução diluída de hidróxido de amônio com gotas de fenolftaleína a 0,1%
Tubo C: 10 mL de água
Pela adição de porções de gelo seco aos tubos, ocorre
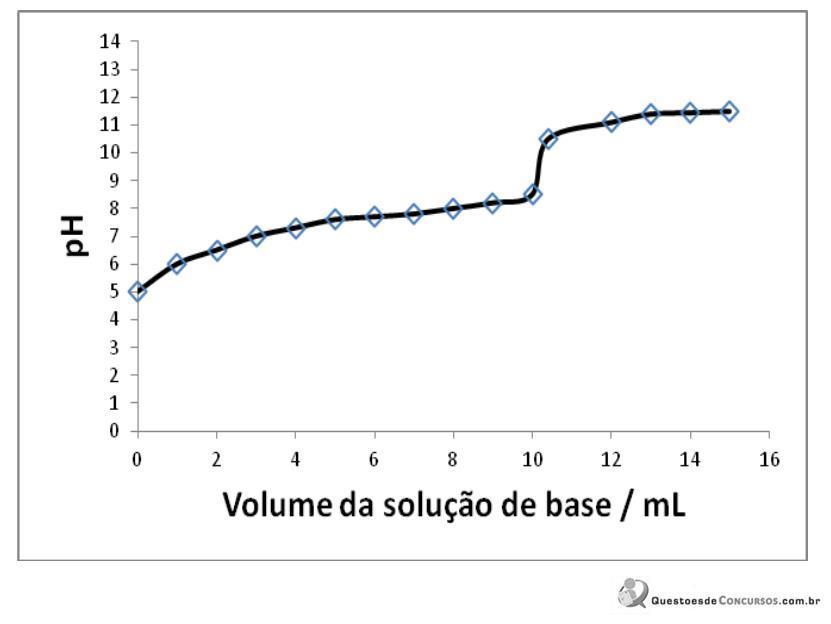
Sobre essa titulação foram feitas as seguintes afirmações:
I. a concentração inicial do ácido é 10-5 mol/L.
II. o ácido envolvido na titulação é fraco.
III. o reagente titulante é uma base forte.
A partir dessa análise, conclui-se que estão CORRETAS as afirmativas

I. aquecimento de CaCO3 puro;
II. combustão de uma vela;
III. reação de raspas de Mg (s) com HCl (aq).
O aparecimento de coloração rosa nos cristais de CoCl2 anidro e a turvação da solução aquosa de Ca(OH)2 foram observados, simultaneamente, em
• Os sólidos foram misturados com água, em recipientes separados, e verificou- se que o de número 2 não dissolveu.
• As duas soluções obtidas foram testadas em relação à condutibilidade elétrica, e apenas a obtida pela dissolução do sólido número 3 resultou condutora.
Os resultados permitem concluir que os sólidos 1, 2 e 3 são, respectivamente,

Um técnico de laboratório distraído preparou solições de carbonato de potássio (K2CO3),
hidróxido de sódio (NaOH) e de hidróxido de cálcio (Ca(OH)2), colocando- se em três frascos não rotulados ( frascos X, Y E Z ).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos,
amostras de cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos frascos X e Z, mas ocorreu uma efervenscência no
tuboque continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco ( frasco X, Y e Z ) em tubos de ensaios limpos.
Observou que só houve formação de precipitado quando misturou as soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.

Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.

Sabendo-se, então, que o coeficiente de solubilidade do K2Cr2O7 é de 12,0 gramas em 100 mL de água à T=200 C, que tipo de sistema será formado quando forem adicionadas 120 gramas de K2Cr2O7 em 600 mL de água à T=200 C?
saponificação dos óleos vegetais são utilizados como sabões.
Entretanto, em regiões cujas águas são ricas em metais
alcalinoterrosos (chamadas águas duras), principalmente Ca2+ eMg 2+
, os sabões perdem eficiência devido à baixa solubilidade dos
sais orgânicos desses metais, o que causa a precipitação.
Com base nessas informações e considerando as soluções ideais,
julgue os itens 148 e 149 e assinale a opção correta no item 150, que
é do tipo C.
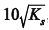 em que Ks é a constante do produto de solubilidade do oleato de cálcio.
em que Ks é a constante do produto de solubilidade do oleato de cálcio.