Questões de Vestibular
Sobre substâncias e suas propriedades em química
Foram encontradas 867 questões

Considerando as informações apresentadas, qual é o valor de ângulo, para a molécula do diclorometano, entre as ligações H–C–H que mais se aproxima do observado experimentalmente?
DADOS QUE PODEM SER USADOS NESTA PROVA


Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
O metano (CH4), gás amplamente utilizado como combustível, tem sido utilizado como uma alternativa de energia mais limpa em comparação a outros hidrocarbonetos mais pesados. A molécula de metano possui geometria
tetraédrica, com ângulos de ligação de aproximadamente 109,5°, e suas forças intermoleculares são do tipo dispersão de London.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Assinale a opção em que são apresentadas, respectivamente, as geometrias moleculares dos compostos SO2, CH2O, HCN e NH3.
B angular; trigonal plana; linear; e piramidal
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
O modelo de repulsão dos pares eletrônicos da camada de valência (VSEPR), útil para a determinação da geometria de uma molécula, leva em consideração apenas os pares de elétrons que participam da ligação química.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
No modelo VSEPR, as ligações simples, duplas e triplas são igualmente tratadas como conjuntos de elétrons durante a determinação da geometria molecular.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Os compostos iônicos possuem pontos de fusão e ebulição mais altos que os compostos moleculares.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Quando átomos se unem por compartilhamento de elétrons, uma ligação iônica se estabelece, denominando-se moléculas os grupos de átomos unidos por meio desse tipo de ligação.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Os ângulos entre as ligações químicas não sofrem interferência da repulsão existente entre os pares de elétrons não compartilhados.
Considerando-se o par de elétrons não ligantes no átomo central, a geometria molecular do composto H3AsO3 é trigonal.
Faça o que se pede no item que é do tipo D.
Explique por que o ligante amônia influencia a geometria molecular do [Co(NH3)6] 2+ e por que o meio básico é essencial para a formação do complexo.
TipoD
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O nitrogênio é mais propenso a formar ligações duplas e triplas que o fósforo, devido ao seu menor raio atômico e à sua maior eletronegatividade.
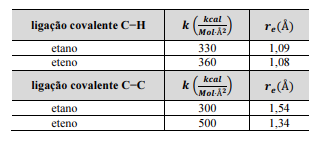
Para a ligação C−H esticada 0,02 Å além da sua distância de equilíbrio, a energia potencial em um eteno será menor que em um etano.

A partir das informações precedentes, julgue o item que se segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva distâncias de equilíbrio, a força de interação na ligação do eteno é duas vezes mais intensa que na ligação do etano.
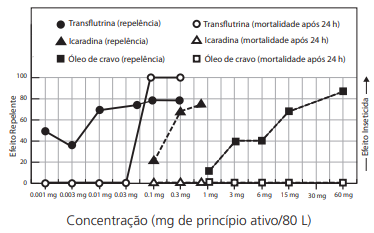
Com base nos resultados experimentais, é correto afirmar que, na faixa considerada,
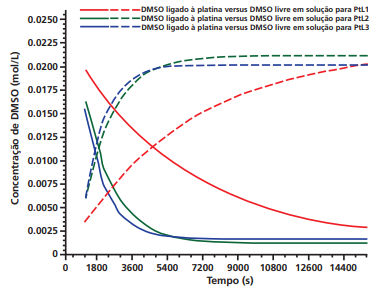
Considerando que quanto menor a velocidade de troca, maior é a eficiência do fármaco, pode-se concluir que

Referência 1. Iminosugars: From synthesis to therapeutic applications; editado por Philippe Compain e Olivier R. Martin, 2007, Editora John Wiley & Sons Ltd, ISBN 978-0-470-03391-3.
A estabilidade e a solubilidade em água são atribuídas à presença de nitrogênio na molécula. Assim, considerando a protonação da Estrutura I, é correto afirmar que isso ocorre devido ao nitrogênio apresentar uma propriedade denominada