Questões de Vestibular de Química - Substâncias e suas propriedades
Foram encontradas 862 questões
Texto adaptado de http://sustentabilidade.estadao.com.br/noticias/geral,poluicao-do-arem-sao-paulo-e-duas-vezes-o-limite-da-oms,10000050538 Acesso em 23 de agosto de 2017.
Acerca dos compostos mencionados no fragmento de texto acima, é possível afirmar que:
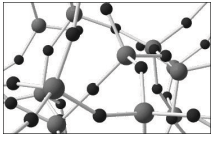 A substância representada por esse modelo
tridimensional pode ser
A substância representada por esse modelo
tridimensional pode ser Considere 4 frascos, cada um contendo diferentes substâncias, a saber:
Frasco 1: 100 mL de H2O(l)
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de HNO3 de concentração 1,2 mol/L
A cada um desses frascos, adicionaram-se, em experimentos distintos, 100 mL de uma solução aquosa de HCl de concentração 1,0 moI/L. Medindo-se o pH do líquido contido em cada frasco, antes e depois da adição de HCl(aq), pôde-se observar aumento do valor do pH somente







