Questões de Vestibular de Química - Substâncias e suas propriedades
Foram encontradas 862 questões
Um dos compostos do chumbo é o Pb3O4 . Em relação a esse composto, pode-se afirmar que
Considere a reação simplificada da síntese do Ácido Acetilsalicílico:
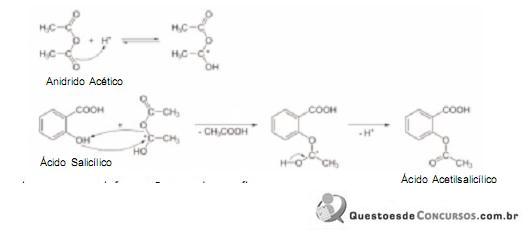
Com base nessas informações, pode-se afirmar que:
I o pH de uma solução 0,0010 M de Ácido Acetilsalicílico é igual a 11,00;
II na reação mostrada, o pH da solução está abaixo de 7,00;
III uma hidrólise no grupo funcional éster do Ácido Acetilsalicilíco com excesso de
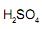 origina uma solução de pH acima de 7,00;
origina uma solução de pH acima de 7,00; IV um isômero do Ácido Salicílico é o Ácido Meta-Hidroxibenzóico;
V na fórmula estrutural do Ácido Acetilsalicílico todos os átomos de Carbono são trigonais planares.
Assinale a opção correta.
Ordene a segunda coluna de acordo com a primeira, de forma a estabelecer a relação entre elas.
Coluna 1
A – Efeito da acidez
B – Efeito da temperatura
C – Exemplo de substância orgânica
D – Exemplo de substância apolar
E – Explosão
F – Reação de simples troca entre um metal e um sal
Coluna 2
( )Esverdeamento da gema
( )Aumento da pressão
( )Ao envelhecer, o deslocamento do equilíbrio leva ao descolamento da membrana interna do ovo
( )Sulfeto de ferro
( ) Colesterol
( )Água
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
I. FeS2 + O2 → Fe2(SO4)3 + SO2
II. Fe2(SO4)3 + H2O → Fe(OH)3 + H2SO4
III. H2SO4 + KNO3 → KHSO4 + HNO3
A partir da leitura do texto e da interpretação das equações, assinale com V ou F, conforme sejam verdadeiras ou falsas, as assertivas abaixo.
( ) A equação I traduz uma reação de deslocamento.
( ) A soma dos coeficientes da equação II é 13.
( ) Na equação III, existe um sal ácido.
( ) Na pirita, o nox do ferro é +2.
( ) Para produzir 94,5 kg de ácido nítrico, são necessários 121,5 kg de salitre.
( ) A equação II traduz uma reação de óxido redução.
A sequência correta, de cima para baixo, é:
Em um Laboratório de Química Orgânica existem diversas substâncias químicas, como metanol, acetato de etila, trietilamina e acetato de sódio. Considerando essas quatro substâncias, analise as proposições.
I. A trietilamina não realiza ligações de hidrogênio entre suas moléculas.
II. O acetato de sódio apresenta somente ligações covalentes polares.
III. O acetato de etila é um éter e apresenta ligações covalentes polares.
IV. O metanol apresenta ligações covalentes polares e não realiza ligações de hidrogênio entre suas moléculas.
V. As quatro substâncias apresentam somente ligações covalentes polares e apolares.
Assinale a alternativa correta.