Questões de Vestibular
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 305 questões
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O número de átomos de cobalto em 235,6 g de cobalto metálico é superior a 2,6 × 1024.
I. Os elementos da série de metais de transição estão situados no bloco d, entre os grupos 2 e 13 da tabela periódica. II. Nessa série, elétrons adicionais são colocados nos orbitais 3d, de acordo com a regra de Hund. III. O germânio, rigorosamente, por conta de sua distribuição eletrônica, é também considerado um metal de transição. IV. A distribuição eletrônica do metal em transição níquel é [Ar] 3d8 4s2.
Estão corretas
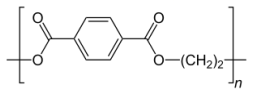
Considerando apenas as ligações entre os átomos de carbonocom carbono e carbono com hidrogênio, os números deligações sigmas (σ), dos tipos: sp3- s ; sp2- sp2; sp2- s, e dotipo pi (π) p - p, encontrados na estrutura do monômero dopolímero PET são

I. os elétrons são distribuídos em subníveis na ordem dos valores crescentes de “n + ℓ“ (nº quântico principal mais nº quântico secundário). II. dois elétrons de um mesmo átomo não podem ter os mesmos quatro números quânticos. III. a ocupação menos estável dos elétrons nos orbitais de um átomo é aquela em que é máximo o número de elétrons desemparelhados. IV. no estado fundamental, os elétrons ocupam os orbitais atômicos de modo que a energia total do átomo seja a máxima possível.
É correto apenas o que se afirma em


Tendo como referência essas informações, julgue o item seguinte.
Quando o cálcio-41 captura um elétron, é formado o
nuclídeo 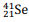 .
.


Tendo como referência essas informações, julgue o item seguinte.
Os íons K+
e Cl−
são isótopos entre si.
Esse elemento químico é denominado:
O radioisótopo 18F é empregado em exames de tomografia por emissão de pósitrons.
O número de nêutrons presentes nesse radioisótopo é igual a:
DADOS QUE PODEM SER USADOS NESTA PROVA

O desenvolvimento da espectrometria de massas levou à confirmação da existência dos
Considere as afirmações abaixo, sobre esse elemento químico.
I - Está localizado no Grupo 10 e no quarto período da tabela periódica. II - Apresenta, em um de seus isótopos, 41 prótons e 52 nêutrons no núcleo atômico. III- Pode ser classificado como um lantanídeo.
Quais estão corretas?
Considere os elementos X, Y e Z da tabela periódica, levando em conta as seguintes afirmações.
1 - X tem 3 elétrons na última camada. 2 - Y tem tendência a formar quatro ligações covalentes. 3 - Z necessita receber dois elétrons para adquirir a configuração de um gás nobre. 4 - Z tem raio atômico semelhante a Y.
Os elementos X, Y e Z são, respectivamente,
Considere três átomos X, Y e Z. Sabe-se que X e Y são isótopos e que os números de prótons dos átomos envolvidos, quando somados, correspondem a 67, da mesma forma que X e Z são isótonos, e que a soma dos nêutrons dessas três espécies é igual a 94.
O valor do número de massa do átomo Z é igual a
A quantidade de elétrons do ânion A3- é igual ao número de prótons do átomo B, que, por sua vez, é isótopo do átomo C, que apresenta número de prótons e número de massa, respectivamente, 49 e 98.
A quantidade de prótons do elemento A é
