Questões de Vestibular
Sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 45 questões
Na reação em questão, a variação da entropia (∆S) é superior a −0,110 kJ/mol.

Texto base para a questão.
Analise a seguinte situação.
Viajar para o Maranhão é conhecer o casario histórico de São Luís, a beleza de tirar o fôlego dos Lençóis Maranhenses, a cultura do bumba meu boi e comer muito bem e sem culpa. A primeira sugestão é deixar a dieta de lado e mergulhar na culinária maranhense, uma das mais ricas do Brasil.
A base dessa cozinha são os frutos do mar. Um dos principais representantes dessa culinária é a Peixada Maranhense. De origem indígena, tem como ingrediente principal a pescada, mas também pode ser feita com outros peixes. Geralmente preparado em panelas (preferencialmente hermeticamente fechadas) que propiciam a adequada variação de temperatura e de pressão. Porém, após a finalização deste prato, um cheiro forte e característico de peixe exala por toda cozinha, em razão da presença de uma amina, especificamente a trimetilamina
A energia gerada pela fonte, acima tratada, é oriunda de uma reação de
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

Equação 1: 3C2H6(g) + 2HgO(s) + 5/2 O2(g) → 2(CH3)2Hg(g) + 2CO2(g) + 3H2O(g)
Equação 2: 3C2H5OH(g) + HgO(s) + 5O2(g) → (CH3)2Hg(g) + 4CO2(g) + 6H2O(g)
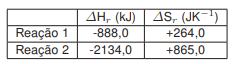
Com base no texto, nos conhecimentos sobre termodinâmica e cinética química, e supondo a queima total de HgO a 1 atm e a 300 K, assinale a alternativa correta.
Dados: Massa molar do metano = 16 g.mol-1 .Calor de combustão do metano , △H° = 210 kcal.mol-1 .
Calor específico da água = 1,0 cal.g-1 .°C-1 .
I. A energia livre depende da temperatura.
II. Todas as reações exotérmicas são espontâneas.
III. Em uma reação química, a variação de entropia é sempre positiva.
IV. Em algumas reações químicas, a variação de entalpia coincide com a variação da energia interna.
V. A variação de entropia de uma reação espontânea pode ser negativa.
É correto somente o que se afirma em
O processo de dissolução do CaCO3 (s) ocorre levando a uma variação da energia livre de Gibbs padrão 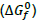 em torno
de +12 kcal.mol-1
, a 25°C e 1 atm. A constante de equilíbrio desse processo está relacionada com a
em torno
de +12 kcal.mol-1
, a 25°C e 1 atm. A constante de equilíbrio desse processo está relacionada com a 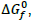 para certa
temperatura T, através da relação
para certa
temperatura T, através da relação 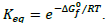 Após essas informações, verifica-se que a reação
Após essas informações, verifica-se que a reação
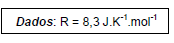
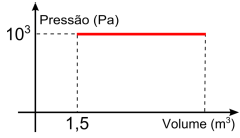
Durante a expansão, a variação de energia interna, em joule, foi de
Questão 38 As chalconas são uma classe de moléculas que possuem vários tipos de atividades farmacológicas. No processo de cristalização de um dos derivados de chalcona, mediu-se uma variação da energia livre de Gibbs e da entalpia a 27 °C de -64 kcal.mol-1 e -164 kcal.mol-1 , respectivamente.
Nesse caso, a temperatura, em Kelvin, a partir da qual a cristalização sofrerá uma transição de um processo espontâneo para não-espontâneo, será de aproximadamente
Hb(aq) + CO(aq)
 HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq)
HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq) HbO2(aq) ΔG° = −70 kJ.mol -1
HbO2(aq) ΔG° = −70 kJ.mol -1 De acordo com as equações químicas acima, qual é a variação de energia livre para a reação de substituição do CO ligado à hemoglobina (HbCO) pelo O2?
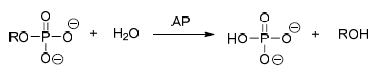
Considere as afirmações e assinale a alternativa correta.
Todos os gases na condição de baixa massa específica obedecem à lei dos gases ideais.
Considerando-se a constante dos gases ideais igual a 8,3J/mol.K, é correto afirmar:
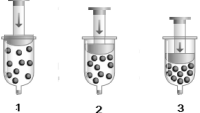
(Fonte Figura: Santos e Mól – Quimica Cidadã- 1ª série Editora AJS-SP(2011)).
Admitindo que o experimento tenha sido realizado em temperatura constante, pode-se afirmar que o gráfico que representa a transformação gasosa acima é: