Questões de Vestibular
Sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 45 questões
Fonte: <https://www.carrodegaragem.com/kit-hidrogenio-veicular-moto-funciona/ >(Adaptado)
Sabemos que a energia proveniente da combustão do hidrogênio vale 1/30 kWh por grama.
Analisando essas informações, assinale a afirmativa INCORRETA em relação ao kit hidrogênio:
C6H12O6(s) + 6 O2(g)
 6 CO2(g) + 6 H2O(l)
6 CO2(g) + 6 H2O(l)
Sabendo os valores de entalpia (∆H = −2.805 kJ.mol−1) e entropia (∆S = 259 J.mol−1.K−1), à temperatura ambiente (25°C = 298 K), determine a energia livre de Gibbs (∆G) para esta reação e indique se a reação é espontânea ou não
DADOS QUE PODEM SER USADOS NESTA PROVA:

Josiah Willard Gibbs (1839 – 1903) foi um pesquisador norte-americano que contribuiu para a determinação da energia livre de um sistema termodinâmico através de uma lei que é associada ao seu nome. Em se tratando de energia livre e de entropia, analise as seguintes proposições:
I. A energia livre pode ser positiva ou negativa, mas nunca pode ser nula.
II. A energia livre é a totalidade de energia de um sistema termodinâmico, que pode ser usada para a realização de trabalho útil.
III. Toda a reação exotérmica é espontânea.
IV. A variação de entropia de uma reação espontânea pode ser negativa.
V. Em certas reações químicas a variação de entalpia coincide com a variação da energia interna.
É correto o que se afirma somente em
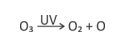
O gráfico representa a energia potencial de ligação entre um dos átomos de oxigênio que constitui a molécula de O3 e os outros dois, como função da distância de separação r.
A frequência dos fótons da luz ultravioleta que corresponde à energia de quebra de uma ligação da molécula de ozônio para formar uma molécula de O2 e um átomo de oxigênio é, aproximadamente .
Assinale a alternativa que contém o calor necessário para elevar a temperatura de 25,0 g de perclorato de potássio da temperatura ambiente até sua temperatura de fusão em 525°C. Dado: capacidade calorífica: 5,85 kJ K-1 mol-1 .
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
1. C(s) + O2(g) ⇾ CO2(g) ΔH = - 94,1 kcal 2. H2(g) + ½ O2(g) ⇾ H2O(g) ΔH = - 68,3 kcal 3. C6H12O6(s) + 6 O2(g)⇾ 6CO2(g) + 6 H2O ΔH = - 673,0 kcal
Considerando as reações que conduzem à formação da glicose e apenas as informações acima, pode-se afirmar corretamente que o processo é

Considerando-se o valor da constante de Faraday 96.500 C, conhecendo-se os potenciais de redução para as semirreações que ocorrem na pilha, Sn/Sn2+ // Pb2+/Pb, cujas concentrações de Sn e Pb valem, respectivamente, 1,0 M e 10-3 M, e sabendose, ainda, que:
Sn2++ 2e-→ Sn Eo= - 0,14 V Pb2+ + 2e-→ Pb E = - 0,22 V,
pode-se afirmar corretamente que a reação global da pilha
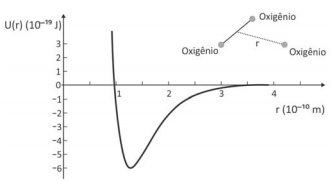
A figura representa o Ciclo de Otto, um ciclo termodinâmico que idealiza o funcionamento de motores de combustão interna de ignição por centelha.
Considerando-se os gases resultantes da combustão como gases ideais e as etapas de transformação apresentadas no diagrama pressão-volume, é correto afirmar:
( ) A densidade da gasolina permanece constante no intervalo térmico entre 25 ºC e 68,7 ºC, nas condições normais de pressão.
( ) A densidade da mistura de massas iguais de gasolina e de etanol, a 20 ºC, é, aproximadamente, 7,7.102 kg/m3 .
( ) Um carro com tanque de capacidade 60 litros pode ser abastecido com 50,0 litros de gasolina a 20 ºC e estacionado ao Sol até atingir a temperatura de 35 ºC, sem que o combustível transborde.
( ) O volume de 1,0m3 de etanol necessita de 7,44.106 J de energia para que vaporize.
A alternativa que indica a sequência correta, de cima para baixo, é a

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Apressão de vapor é uma importante propriedade físico-química das substâncias e das soluções.
Com base nos dados fornecidos e nos conhecimentos de química, é correto afirmar:

Observação: Algumas das questões desta prova são adaptações de situações reais. Alguns
dados e condições foram modificados para facilitar o trabalho dos candidatos.
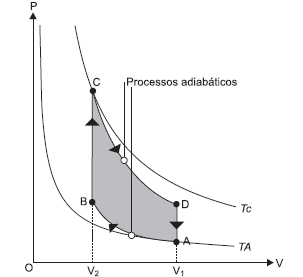
Pedrinho, ao chegar da escola, explica para sua avó o que aprendeu sobre o funcionamento de uma panela de pressão. Ela ficou surpresa em saber como um utensílio doméstico comum serve para exemplificar e explicar muitos princípios físicos.
Independentemente de marca e modelo, além de cabos e tampa, toda panela de pressão é constituída basicamente de uma válvula com pino, que serve para controlar a pressão dentro da panela, e de uma válvula de segurança que se rompe, caso a válvula com pino não seja acionada.
Com base no funcionamento da panela, nos princípios e fenômenos físicos envolvidos e no diagrama de fase acima, assinale a proposição CORRETA.
Na panela de pressão em contato com a chama, ocorre uma transformação isobárica
quando a válvula com pino é acionada.
A condutividade térmica é uma propriedade muito importante na seleção de materiais para diversas aplicações. Em muitas situações são necessários materiais isolantes, isto é, com baixa condutividade térmica, enquanto que em outras são necessários materiais com elevada condutividade térmica. Por exemplo, os materiais utilizados para aquecimento devem possuir elevada condutividade térmica. De igual modo, a condutividade térmica de alguns materiais para aplicações elétricas ou eletrônicas é essencial para dissipar o calor que se produz por efeito Joule. A capacidade calorífica específica ou calor específico(Cp) é a quantidade de calor necessária para elevar, de um grau Celsius, a temperatura de um grama da substância a pressão constante. Abaixo estão apresentados a condutividade térmica e o calor específico de alguns materiais.

Julgue os itens abaixo relativos à situação hipotética acima, no que se refere ao equilíbrio térmico alcançado quando a água volta a entrar em ebulição.
I - As três peças estão em equilíbrio térmico com a água mas apresentam temperaturas diferentes umas das outras.
II - As três peças recebem a mesma quantidade de calor da água, tendo em vista que apresentam a mesma diferença de temperatura em relação à água em ebulição.
III - A peça de cobre é a que recebe mais calor, pois possui a maior condutividade térmica.
IV - A peça de poliestireno é a que recebe mais calor, porque apresenta a maior capacidade calorífica das três. No equilíbrio térmico, esta peça fica com a mesma temperatura (100°C) das demais e também da água que a envolve.
Está(ão) correto(s):
