Questões de Vestibular
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 82 questões
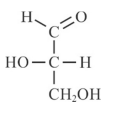
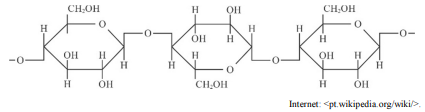
Com base nas informações do texto antecedente, julgue o item.
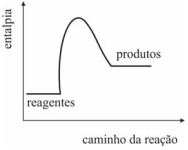
O gráfico a seguir representa corretamente a variação de entalpia da reação da fotossíntese ao longo da reação.
Considere a seguinte reação reversível genérica:
A + B ⇌ C + D
O gráfico termoquímico para essa reação está demonstrado na figura a seguir.
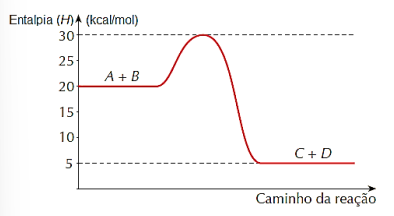
De acordo com os dados do gráfico, assinale
a alternativa correta.
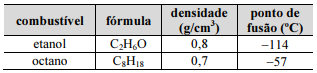
Maior causador do efeito estufa, o CO2 é liberado pela queima de combustíveis como o octano, um dos principais componentes da gasolina, e o etanol, obtido de biomassa. A esse respeito e considerando os dados na tabela precedente, julgue os item.
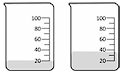
Considerando a combustão total, assinale a opção que representa corretamente os volumes dos combustíveis octano (à esquerda) e etanol (à direita) que devem ser queimados para que haja emissão de uma quantidade equivalente de CO2 pelos dois compostos.
Tendo como referência as informações precedentes, julgue o item que se segue.
O valor da variação de entalpia molar da reação em relação
à hematita, que reage com o monóxido de carbono,
produzindo apenas ferro metálico e dióxido de carbono, é
3 ΔHI + 2 ΔHII +ΔHIII.
LIGAÇÃO ENERGIA DE LIGAÇÃO (kJ/mol) C—H 410
Cl—Cl 240
C—Cl 330
H—Cl 430
A energia, em quilojoules, liberada na formação de 1,0 mol de diclorometano é igual a:
O gráfico a seguir representa corretamente a reação de combustão da madeira usada na queima da argila para a formação da cerâmica.
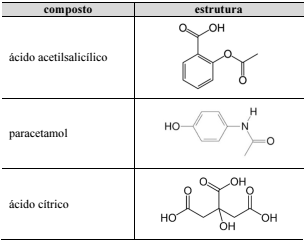
Os compostos orgânicos listados na tabela precedente são amplamente utilizados em medicamentos, entre os quais estão incluídos os efervescentes. Estes resultam da combinação de sólidos misturados e prensados para formar um comprimido contendo o fármaco ácido e um composto básico, como o NaHCO3. Quando o medicamento é colocado na água, a reação entre esses compostos libera CO2, que forma as bolhas na efervescência, como representado para o ácido acetilsalicílico na reação a seguir. Existem, também, vários compostos inorgânicos que são empregados na fabricação de medicamentos, como o FeSO4 e o KMnO4.
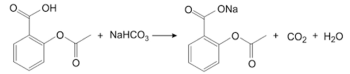
Tendo como referência as informações precedentes, julgue o item.
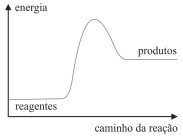
Sabendo que o KMnO4 reage com a glicerina em uma reação que libera bastante calor, é correto concluir que a variação de energia para essa reação pode ser corretamente representada pelo gráfico a seguir.
DADOS QUE PODEM SER USADOS NESTA PROVA

Atente para as informações contidas na seguinte tabela:
Substância Calor de combustão (kcal/mol)
Carbono 1.646,92
Metano 3.720,20
Butano 12.038,40
Octano 22.822,80
De acordo com as informações da tabela acima, o
combustível capaz de produzir a maior quantidade de
calor por quilograma queimado é o
Considere o ciclo para o NaCl na figura a seguir:
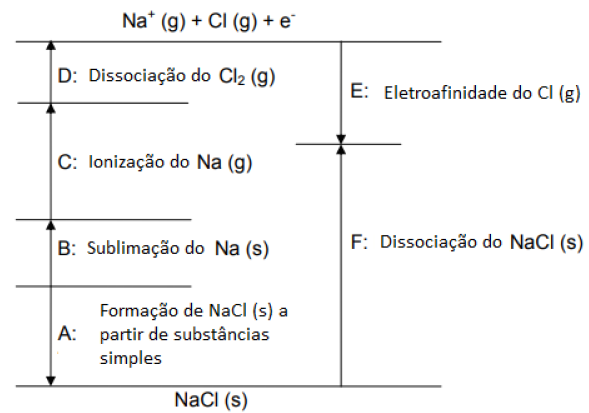
A representação CORRETA de um dos processos que ocorrem nesse ciclo é:
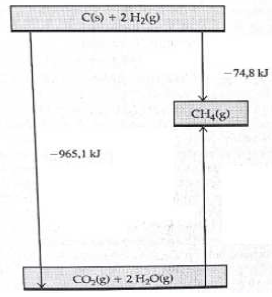
A energia envolvida na formação do gás metano a partir de gás carbônico e água é:
No fragmento a seguir, o autor explora conceitos químicos na forma de poesia:
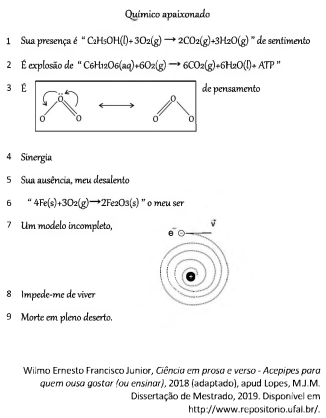
Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada a corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Está correto o que se afirma no(s) item(ns):
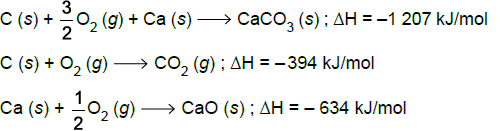
A partir dessas equações, pode-se prever que o ∆H da reação de decomposição do calcário que produz cal viva (cal virgem) e dióxido de carbono seja igual a
Considere a combustão completa de etanol suficiente para gerar um calor de 1.105 kJ.

Com base na entalpia de formação aproximada dos compostos dados na tabela, a massa de gás carbônico, em kg, liberada nessa queima é de, aproximadamente:
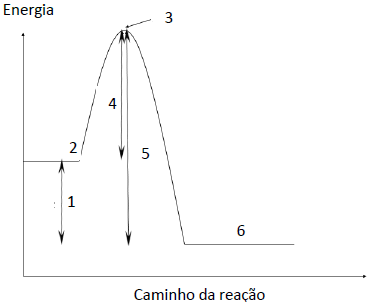
Energia de ativação, variação de entalpia da transformação e complexo ativado podem ser, respectivamente, associados aos números
O fenômeno climático das monções, que ocorre na Ásia, propicia a dispersão de poluentes que formam particulados, como o sulfato de amônio [(NH4)2SO4]. Esse composto é formado na atmosfera pela reação da amônia (NH3) com o dióxido de enxofre (SO2), de acordo com as equações:
SO2 (g)+ 1/2O2(g) → SO3 (g)
H2O (ℓ)+SO3(g) → H2SO4 (ℓ)
2NH3 (g) + H2SO4 (ℓ) → (NH4)2SO4 (s)
Considere os valores de entalpia-padrão de formação:
SO2 (g)  = -298 kJ/mol
= -298 kJ/mol
NH3 (g) 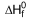 = -46 kJlmol
= -46 kJlmol
H2O (ℓ) 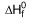 = -286 kJ/mol
= -286 kJ/mol
(NH4)2SO4 (s) 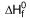 = -1179 kJ/mol
= -1179 kJ/mol
Com base nas informações apresentadas, pode-se afirmar
que a entalpia-padrão de reação de formação de 1 mol de
sulfato de amônio é
Na Figura abaixo, é mostrada a reação de adição do bromo (Br2 ) ao estireno.
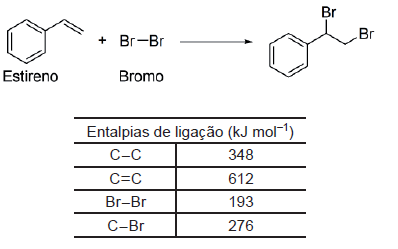
Considerando os valores de entalpia de ligação da Tabela,
o valor da entalpia de reação, em kJ mol-1
, será:

CaCℓ2 (s) + H2O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 . Considere os valores das entalpias de formação indicados na tabela. Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 .
Considere os valores das entalpias de formação indicados na tabela.
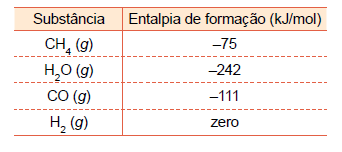
A partir das informações fornecidas, calcula-se que a produção
de cada mol de hidrogênio pela reforma a vapor do metano


