Uma das maneiras de se obter industrialmente o hidrogênio é...
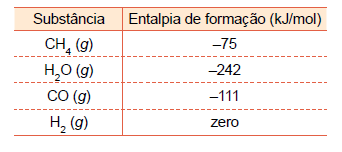
Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 . Considere os valores das entalpias de formação indicados na tabela. Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 .
Considere os valores das entalpias de formação indicados na tabela.
A partir das informações fornecidas, calcula-se que a produção
de cada mol de hidrogênio pela reforma a vapor do metano
- Gabarito Comentado (1)
- Aulas (8)
- Comentários (2)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
CH4 + H2O → CO + 3 H2
Como são 6 hidrogênios nos reagentes, é preciso haver 6 hidrogênios no produto. Para isso, basta adicionar um 3 na frente do H2, como mostrado acima. Com a reação correta, pode-se calcular o ∆H a partir da seguinte fórmula:
O ∆Hprodutos e ∆Hreagentes pode ser calculado a partir do calor de formação das substâncias participantes na reação:
∆Hreagentes = ∆Hf (CH4) + ∆Hf (H2O) = - 75 - 242 = - 317 kJ
∆H = ∆Hprodutos - ∆Hreagentes = - 111 - (-317) = 206 kJ
É preciso prestar atenção que o enunciado requer o calor envolvido na produção de cada mol de hidrogênio. Logo, é preciso calcular o ∆H para 1 mol:
3 mols de hidrogênio ----- 206 kJ
1 ----- X
X = 206/3 = 69 kJ
Como o ∆H é positivo, isso indica que a reação é endotérmica e absorve calor. Portanto, a produção de cada mol de hidrogênio pela reforma a vapor do metano absorve 69 kJ.
Gabarito do Professor: Letra B.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Equação da reforma do metano:
CH4(g) + H2O(g) → CO(g) + 3H2(g)
–75kJ – 242kJ –111kJ 0
Cálculo da variação de entalpia (ΔH):
ΔH = ∑ΔHf (produtos) – ∑ΔHf (reagentes)
ΔH = [(–111) – (–317)] kJ
ΔH = + 206 kJ
206 kJ –––––––– 3 mol de H2
x –––––––– 1 mol de H2
x ≈ 68,67 kJ
A produção de cada mol de hidrogênio pela reforma a vapor do metano absorve, aproximadamente, 69 kJ.
Fonte: https://app.estuda.com
Ainda bem que não tinha os 206 nas alternativas, já iria sair rasgando kkkk
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo