Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 80 questões
DADOS QUE PODEM SER USADOS NESTA PROVA

Atente para as informações contidas na seguinte tabela:
Substância Calor de combustão (kcal/mol)
Carbono 1.646,92
Metano 3.720,20
Butano 12.038,40
Octano 22.822,80
De acordo com as informações da tabela acima, o
combustível capaz de produzir a maior quantidade de
calor por quilograma queimado é o
Cgraf + O2(g) → CO2(g)
 = -393,3 kJ Cdiam + O2(g) → CO2(g)
= -393,3 kJ Cdiam + O2(g) → CO2(g)  = -395,2 kJ Cgraf → Cdiam
= -395,2 kJ Cgraf → Cdiam  = ?
= ? A partir dos valores de entalpia de formação do CO2, qual é a entalpia de reação para a transformação do carbono grafite em carbono diamante?
Considere o ciclo para o NaCl na figura a seguir:
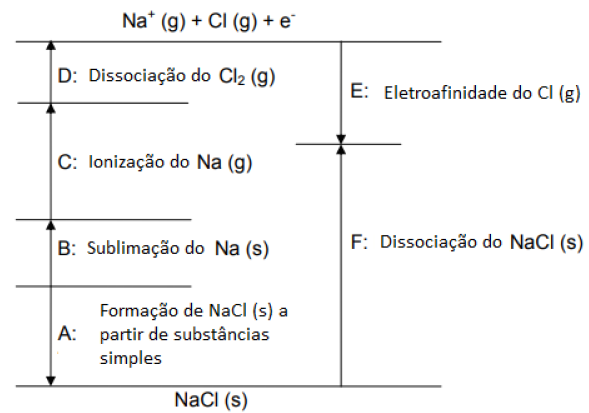
A representação CORRETA de um dos processos que ocorrem nesse ciclo é:
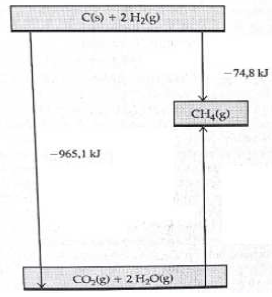
A energia envolvida na formação do gás metano a partir de gás carbônico e água é:
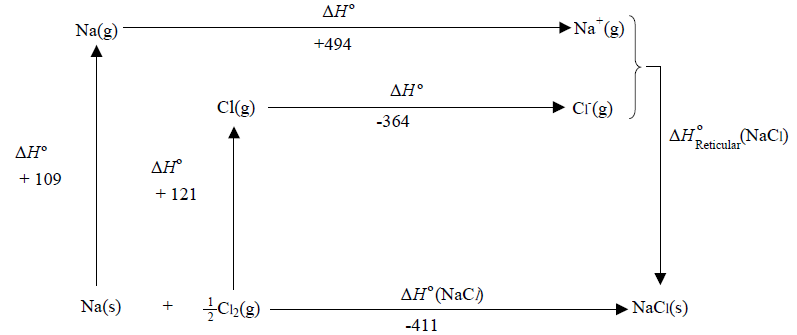
Considerando a relação da energia reticular, U ou ∆Hºreticular, do cloreto de sódio com outros dados termoquímicos, é CORRETO afirmar que, para

