Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 80 questões

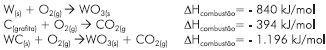

De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:
CaCℓ2 (s) + H2O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
