Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
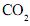 liberada na queima do combustível.
liberada na queima do combustível. Neste quadro, apresentam-se alguns hidrocarbonetos usados como combustíveis, em diferentes circunstâncias, bem como suas correspondentes variações de entalpia de combustão completa:
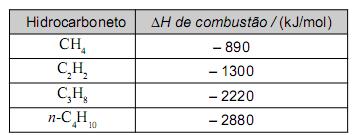
Tendo-se em vista essas informações, é CORRETO afrmar que, entre os hidrocarbonetos citados, aquele que, em sua combustão completa, libera a maior quantidade de energia por mol de
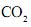 produzido é o
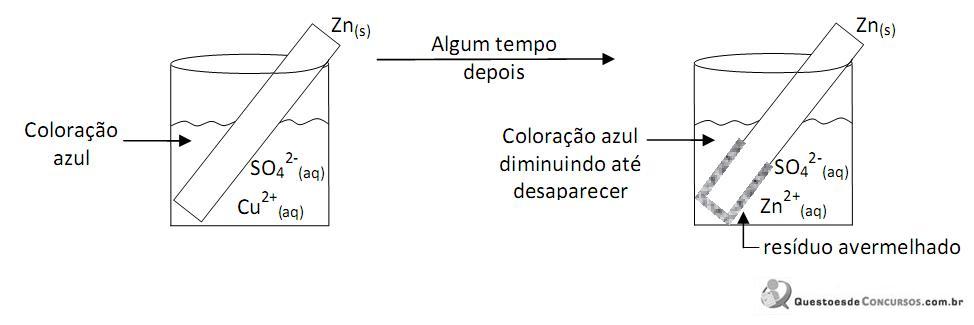
produzido é o  observou-se, durante a dissolução, um resfriamento do sistema
observou-se, durante a dissolução, um resfriamento do sistemaConsiderando-se a situação descrita e outros conhecimentos sobre o assunto, é CORRETO afrmar que
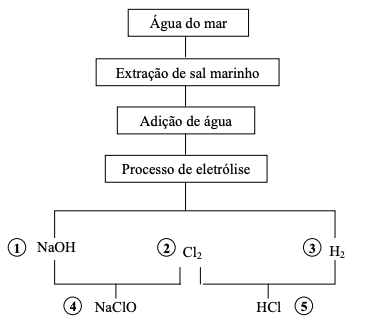
A partir dessas informações, analise as afirmativas.
I - O subproduto 1 da eletrólise é o hidróxido de sódio, conhecido como soda cáustica, matéria-prima utilizada na fabricação de sabão, detergentes e papel. II - Para obtenção de 36,5 g do subproduto 5 são necessários 0,5 mol de H2 e 0,5 mol de Cl2. III - A eletrólise ocorrida entre o sal marinho e a água é uma reação espontânea, sem necessidade de energia para a sua realização. IV - O subproduto 4 é utilizado para lavagem de roupas coloridas. V - O subproduto 3 é extremamente reativo e perigoso, utilizado na produção de amônia.
Estão corretas as afirmativas
A transformação isotérmica:
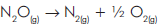
apresenta, na temperatura de 25o
C, variação de entalpia
de –19,5 kcal/mol e variação de entropia de
18 cal/K.mol. Podemos afirmar que a variação de
energia livre desse sistema é
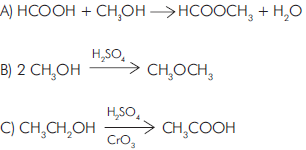
( ) O potencial padrão de redução do alumínio (E° = −1,66V) mostra que ele é facilmente oxidado. ( ) A resistência do alumínio à corrosão deve-se à formação de uma camada fina, dura e transparente de Al2O3 que adere à superfície do metal. ( ) A quantidade de matéria de alumínio necessária para se obter 204g de Al2O3 é 2,5 mols. ( ) O átomo de alumínio possui número atômico 13 e massa 26,98u.
Assinale a seqüência correta.

Julgue os itens abaixo relativos à situação hipotética acima, no que se refere ao equilíbrio térmico alcançado quando a água volta a entrar em ebulição.
I - As três peças estão em equilíbrio térmico com a água mas apresentam temperaturas diferentes umas das outras.
II - As três peças recebem a mesma quantidade de calor da água, tendo em vista que apresentam a mesma diferença de temperatura em relação à água em ebulição.
III - A peça de cobre é a que recebe mais calor, pois possui a maior condutividade térmica.
IV - A peça de poliestireno é a que recebe mais calor, porque apresenta a maior capacidade calorífica das três. No equilíbrio térmico, esta peça fica com a mesma temperatura (100°C) das demais e também da água que a envolve.
Está(ão) correto(s):
Assinale a alternativa verdadeira.

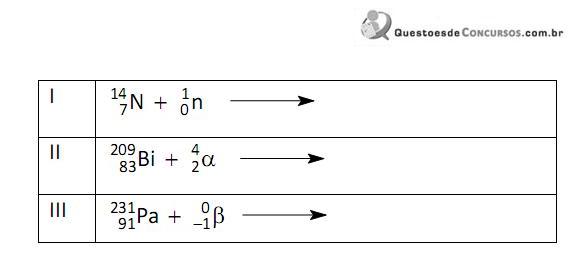
Pode-se dizer que houve uma transmutação. Assinale a alternativa que apresenta os elementos que completam corretamente as reações I, II e III, respectivamente.

O potencial total para essa pilha é:
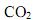 na atmosfera, resultante da queima de combustíveis orgânicos, contribui para a intensificação do efeito estufa e o conseqüente aumento no aquecimento global do planeta. A 25 °C, a queima do etanol e do metano libera 1.400 kJ/mol e 900 kJ/mol de energia, respectivamente. A razão entre a quantidade de energia liberada por mol de
na atmosfera, resultante da queima de combustíveis orgânicos, contribui para a intensificação do efeito estufa e o conseqüente aumento no aquecimento global do planeta. A 25 °C, a queima do etanol e do metano libera 1.400 kJ/mol e 900 kJ/mol de energia, respectivamente. A razão entre a quantidade de energia liberada por mol de 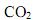 emitido pela combustão do etanol e do metano são, respectivamente:
emitido pela combustão do etanol e do metano são, respectivamente: As reações de formação do dióxido de enxofre e do trióxido de enxofre e as respectivas variações de entalpia, ΔH, são:
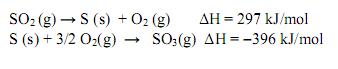
A formação de trióxido de enxofre a partir do dióxido de enxofre é dada pela reação:
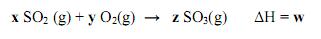
A alternativa que representa os valores indicados por x, y, z e w é:
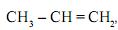 ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,
ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila, 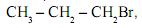 e o brometo de isopropila,
e o brometo de isopropila, 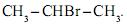
As reações responsáveis pela formação desses compostos estão representadas nestas duas equações:
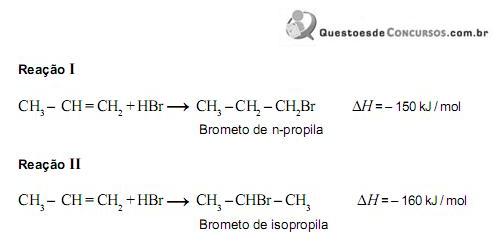
Sabe-se que a velocidade da reação II é maior que a da reação I.
Comparando-se essas duas reações, é CORREtO afrmar que, na II,
Para tanto, cada um desses metais foi mergulhado em três soluções diferentes ? uma de nitrato de cobre,
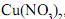 , uma de nitrato de magnésio,
, uma de nitrato de magnésio,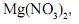 , e uma de nitrato de zinco,
, e uma de nitrato de zinco, 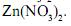 .
. Neste quadro, estão resumidas as observações feitas ao longo dos testes:
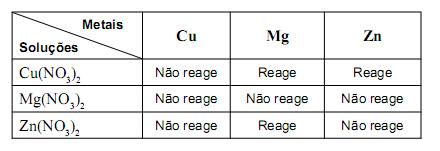
Considerando-se essas informações, é CORREtO afrmar que a disposição dos três metais testados, segundo a ordem crescente de reatividade de cada um deles, é

Considerando as informações apresentadas, julgue os itens
seguintes.

Considerando as informações apresentadas, julgue os itens
seguintes.
Considere uma bateria de chumbo com ddp de 12 V. As duas
semi-reações não-balanceadas dessa bateria são apresentadas a seguir.

Com relação a essas reações, julgue os próximos itens.
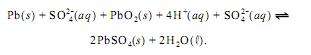
Sabendo que o potencial de redução da reação I, quando balanceada, é -0,35 V, calcule, em volts, o potencial de redução da reação II balanceada. Multiplique o valor obtido por 100, e desconsidere, para a marcação na folha de respostas, a parte fracionária do resultado final obtido, após realizar todos os cálculos solicitados.
( a resposta é 165 ).
