Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 963 questões
Para a geração de 36 mg de H2 por hora a partir da eletrólise da água, a corrente elétrica média necessária deverá ser superior a 0,80 A.
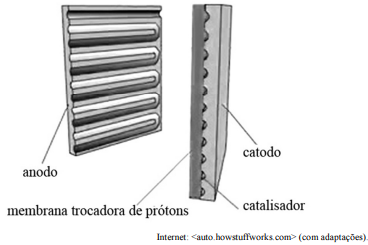
Tendo o texto precedente como referência inicial, julgue o item.
Na célula a combustível, a função do catalisador é reagir com os íons hidrogênio, com a molécula de oxigênio e com os elétrons recebidos do anodo para gerar energia.

Tendo o texto precedente como referência inicial, julgue o item.
A reação eletroquímica que ocorre em uma célula a combustível produz CO2 e H2O.

Tendo o texto precedente como referência inicial, julgue o item.
Na reação que ocorre na célula a combustível, o hidrogênio é o agente oxidante e o oxigênio, o agente redutor.

Tendo o texto precedente como referência inicial, julgue o item.
As semirreações que ocorrem no anodo e no catodo são apresentadas a seguir, conforme as informações do texto.
anodo: 2 H2 → 4 H+ + 4 e−
catodo: O2 + 4 H+ + 4 e− → 2 H2O
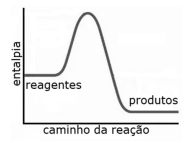
Com base nas informações do texto antecedente, julgue o item.
O gráfico a seguir representa corretamente a variação de entalpia da reação da fotossíntese ao longo da reação.
Após 20 anos, mais de 80% da massa original de 60Co terá sido convertida a 60Ni por meio do decaimento radioativo.
O decaimento radioativo do 60Co a 60Ni envolve a emissão de uma partícula β.
O principal risco envolvido nos processos radioativos é que as radiações emitidas contribuem para o fenômeno do aquecimento global.
Em seu estado fundamental de energia, o átomo de níquel neutro possui elétrons desemparelhados.
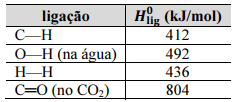
No processo de reforma a vapor do metano, a separação do H2 a partir da mistura reacional pode ser realizada facilmente porque, após o resfriamento do sistema, a água condensará e solubilizará o H2, devido à formação de ligações de hidrogênio entre as moléculas de H2O e H2; após a remoção dos gases não dissolvidos, o H2 dissolvido na água pode ser liberado por meio de um aquecimento brando da mistura.

Considerando-se que os valores de Ho lig apresentados são válidos para as condições em que a reforma a vapor do metano esteja sendo realizada, conclui-se que a entalpia padrão da reação, conforme apresentada, é superior a 300 kJ/mol.
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
A eventual substituição do 2,2,4-trimetilpentano por metano como combustível, admitindo-se combustão completa, permitiria uma redução superior a 20% na quantidade de CO2 liberada para a mesma quantidade de energia gerada.
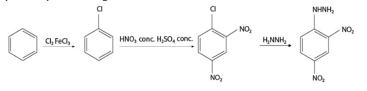
Na reação em tela, ocorre a oxidação do arsênio de um estado de oxidação +3 para um +5.
Na reação em questão, a variação da entropia (∆S) é superior a −0,110 kJ/mol.
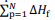 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 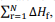 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.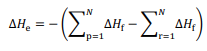
Assumindo-se que a temperatura do meio reacional aumente 25 °C com a explosão, que a pressão seja constante e que o rendimento da reação tenha sido de 100%, conclui-se que o volume total de gases produzidos na decomposição do RDX será inferior a 0,95 L por grama de explosivo.
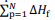 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 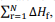 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.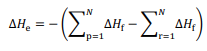

Considere que a entalpia de formação (ΔHf) do RDX seja +83,82 kJ/mol e que os valores de ΔHf para CO, H2O e N2 sejam, respectivamente, −111,8 kJ/mol, −240,6 kJ/mol e 0,0 kJ/mol. Nessas condições, o calor liberado pela detonação de 1 kg de RDX será inferior a 5.000 kJ.

A entalpia de vaporização caracteriza-se por ser sempre positiva.

A entalpia de um sistema é uma grandeza, expressa em unidade de energia, que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo a pressão constante.

A reação de combustão do gás hidrogênio gera água na forma de vapor; se a reação gerasse água na forma líquida, a liberação de energia seria a mesma.