A partir dessas informações e considerando que o volume mola...
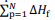 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 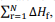 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.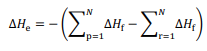
Considere que a entalpia de formação (ΔHf) do RDX seja +83,82 kJ/mol e que os valores de ΔHf para CO, H2O e N2 sejam, respectivamente, −111,8 kJ/mol, −240,6 kJ/mol e 0,0 kJ/mol. Nessas condições, o calor liberado pela detonação de 1 kg de RDX será inferior a 5.000 kJ.
Comentários
Veja os comentários dos nossos alunos
Primeiro calculamos a variação de entalpia /\H = Hp-Hr:
- 3.(-118,8) + 3.(-240,6) - 83,82.
- /\H = 1.141,02 kj.mol-¹
1 mol de RDX possui 222g em massa, logo em 1.000g de RDX teremos 4,5 mol.
Agora é só multiplicar a variação de energia para 4,5 mol. 4,5 . 1141,02 = 5.139,7 kj.mol-1
Gabarito: E
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo