Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 963 questões
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

Ag+(aq) + e– → Ag(s) Eo = + 0,80 volts Zn2+(aq) + 2e– → Zn(s) Eo = – 0,76 volts 2H+(aq) + 2e– → H2(g) Eo = 0,00 volts Pb2+(aq) + 2e– → Pb(s) Eo = – 0,13 volts Aℓ3+(aq) + 3e– → Aℓ (s) Eo = – 1,66 volts
Considerando as semirreações e seus potenciais padrões de redução, acima apresentados, é correto afirmar que Lindalva deve escolher o vasilhame de
DADOS QUE PODEM SER USADOS NESTA PROVA

Atente para as informações contidas na seguinte tabela:
Substância Calor de combustão (kcal/mol)
Carbono 1.646,92
Metano 3.720,20
Butano 12.038,40
Octano 22.822,80
De acordo com as informações da tabela acima, o
combustível capaz de produzir a maior quantidade de
calor por quilograma queimado é o
H3CCOH + 2Ag+ + 2NH3 + H2O → H3CCOOH + 2Ag(s) + 2NH+4
Assinale a alternativa que apresenta, corretamente, o agente redutor nessa reação.
 Po, as etapas sucessivas a seguir são observadas.
Po, as etapas sucessivas a seguir são observadas.
I.
 Po → α + W II. W → β + R
Po → α + W II. W → β + R
Com base nessas informações e nos conhecimentos sobre radioatividade, assinale a alternativa que indica, corretamente, o número de nêutrons que o núcleo do elemento R apresenta.
Substância Entalpia de formação (kcal/mol) CO2 −95,0 CO −25,0
Com base nessas informações e nos conhecimentos sobre termoquímica, assinale a alternativa que apresenta, corretamente, a entalpia da reação C(s) + CO2(g) → 2CO(g).
Com base no texto e nos conhecimentos sobre reações de oxirredução, considere as afirmativas a seguir.
I. O número de oxidação de qualquer elemento, ao formar uma substância simples, é zero. II. Agente redutor é a substância ou elemento que, após a reação, apresenta um número de oxidação maior. III. Agente oxidante é a substância que contém o elemento que sofre oxidação. IV. A soma algébrica dos números de oxidação de todos os átomos em um íon é zero.
Assinale a alternativa correta.
Dados: Massas molares em g.mol−1 : Au = 197; Br = 80.
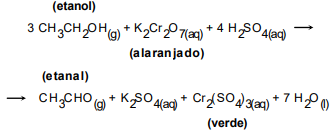
Após a reação redox, ocorre uma mudança de coloração promovida pelos compostos de cromo (Cr), levando à formação do etanal. Com base na equação química acima, qual é o número de oxidação do cromo (Cr) nos compostos K2Cr2O7 e Cr2(SO4)3, respectivamente?
Cgraf + O2(g) → CO2(g)
 = -393,3 kJ Cdiam + O2(g) → CO2(g)
= -393,3 kJ Cdiam + O2(g) → CO2(g)  = -395,2 kJ Cgraf → Cdiam
= -395,2 kJ Cgraf → Cdiam  = ?
= ? A partir dos valores de entalpia de formação do CO2, qual é a entalpia de reação para a transformação do carbono grafite em carbono diamante?
HCl(aq) + NH3(aq) → NH4Cl(s)
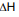 = ???
= ??? A partir dos valores das entalpias de formação do HCl (
 = -46 kJ.mol-1), NH3 (
= -46 kJ.mol-1), NH3 ( = -92 kJ.mol-1) e NH4Cl (
= -92 kJ.mol-1) e NH4Cl ( = -314 kJ.mol-1), determine a variação de entalpia
(
= -314 kJ.mol-1), determine a variação de entalpia
(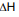 ) da reação acima e se o processo é endotérmico
ou exotérmico.
) da reação acima e se o processo é endotérmico
ou exotérmico. Reação E°red
piruvato + 2H+ + 2e- → lactato -0,185 V
NAD+ + H+ + 2e- → NADH -0,315 V
Com base nos potenciais-padrão de redução apresentados, qual é a variação do potencial padrão
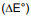 da reação de oxirredução que promove a
formação do lactato?
da reação de oxirredução que promove a
formação do lactato? 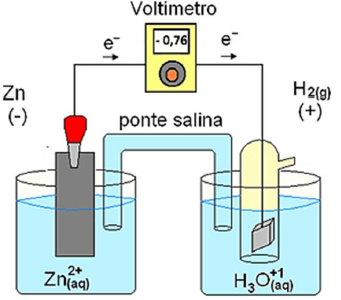
Fonte: https://mundoeducacao.uol.com.br/quimica/potencialpadrao-reducao-das-pilhas.htm. Acesso 15/05/2021.
Em relação a essa pilha, foram feitas as seguintes afirmativas:
I – Durante o funcionamento da pilha, a acidez da solução no catodo diminui. II – Ocorre oxidação da espécie Zn2+(aq). III – A semirreação de redução que ocorre na pilha é: 2H+(aq) + 2e- ➜ H2(g). IV – A força eletromotriz da pilha é dependente da concentração das espécies em solução.
Estão CORRETAS as afirmativas:
Considere o ciclo para o NaCl na figura a seguir:
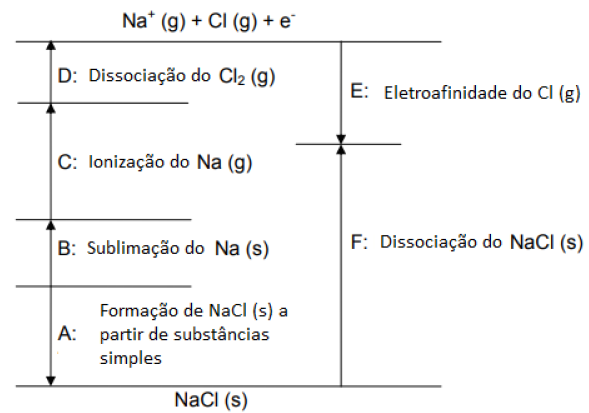
A representação CORRETA de um dos processos que ocorrem nesse ciclo é:
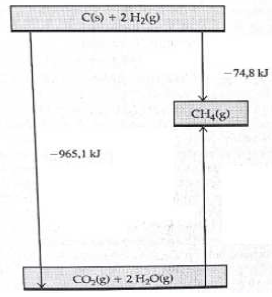
A energia envolvida na formação do gás metano a partir de gás carbônico e água é:
O esquema apresenta uma célula a combustível de ureia, as semirreações e seus potenciaispadrão de redução.
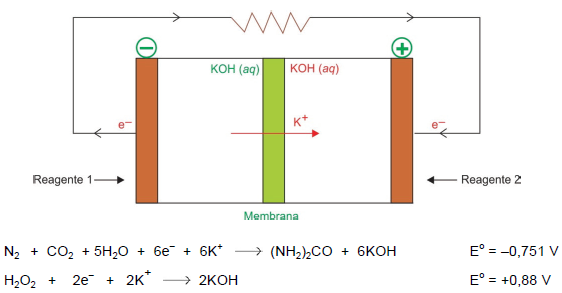
(Ke Ye et al. “Recent Advances in the electro-oxidation of urea for direct urea fuel cell and urea electrolysis”. Topics in Current Chemistry, 2018. Adaptado.)
O potencial-padrão dessa célula a combustível e todos os produtos da reação global são, respectivamente,
O produto de decaimento do samário-153 é o ________________ , e o tempo de meia-vida do iodo-131 corresponde a __________________ tempo de meia-vida do samário-153.
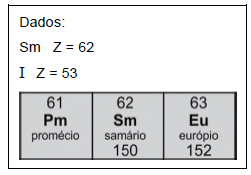
As lacunas são preenchidas por:
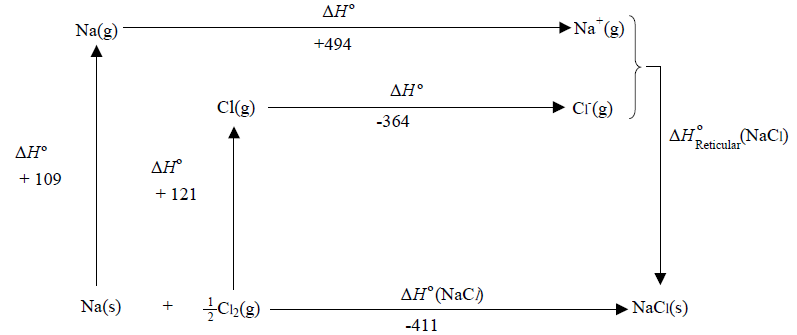
Considerando a relação da energia reticular, U ou ∆Hºreticular, do cloreto de sódio com outros dados termoquímicos, é CORRETO afirmar que, para

