Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
A tradição de produzir joias e semi joias em Juazeiro do Norte vem desde os tempos do Padre Cícero. Como a cidade recebia muitos visitantes para casar e não tinham alianças, surgiam daí as primeiras oficinas de joias. A galvanoplastia utiliza a eletrolise em meio aquoso para cobrir uma determinada peça metálica com outro metal. Na prateação (Ag + ) de uma aliança, fez-se passar pelas células uma corrente de 3,72 ampères durante 20 minutos. Qual a massa de prata, depositada na superfície da aliança. Dados Ag = 108
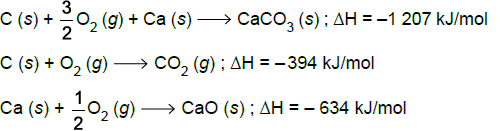
A partir dessas equações, pode-se prever que o ∆H da reação de decomposição do calcário que produz cal viva (cal virgem) e dióxido de carbono seja igual a
Analise as reações.
Reação 1 – Obtenção de água sanitária
Cℓ2 (g) + 2NaOH (aq) → NaCℓ O (aq) + NaCℓ (aq) + H2O (ℓ)
Reação 2 – Reação de carga de uma bateria chumbo/ácido
2PbSO4 (s) + 2H2O (ℓ) → Pb (s) + PbO2 (s) + 2H2SO4 (aq)
Reação 3 – Combustão de magnésio metálico
Mg (s) + 1/2 O2 (g) → MgO (s)
Reação 4 – Obtenção de cal
CaCO3 (s) → CaO (s) + CO2 (g)
São exemplos de oxirredução, que apresentam um reagente atuando simultaneamente como oxidante e redutor, as
reações
Empregado em processos de cromação, o tríóxido de crômio, que é altamente tóxico, corrosivo e carcinogênico, é eventualmente utilizado para a produção de crômio, de acordo com a seguinte reação: 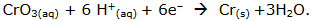
Considerando a reação acima, é correto dizer que a massa, em g, de crômio depositada por 24.125 C é,
aproximadamente
O esquema apresenta uma célula a combustível de ureia, as semirreações e seus potenciaispadrão de redução.
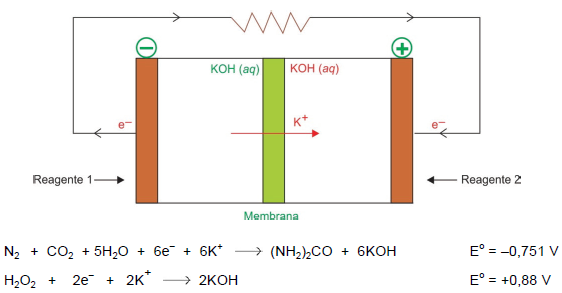
(Ke Ye et al. “Recent Advances in the electro-oxidation of urea for direct urea fuel cell and urea electrolysis”. Topics in Current Chemistry, 2018. Adaptado.)
O potencial-padrão dessa célula a combustível e todos os produtos da reação global são, respectivamente,
O produto de decaimento do samário-153 é o ________________ , e o tempo de meia-vida do iodo-131 corresponde a __________________ tempo de meia-vida do samário-153.
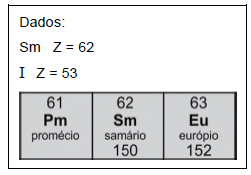
As lacunas são preenchidas por:
Considere a combustão completa de etanol suficiente para gerar um calor de 1.105 kJ.

Com base na entalpia de formação aproximada dos compostos dados na tabela, a massa de gás carbônico, em kg, liberada nessa queima é de, aproximadamente:
Semirreação Eu (V) Al3+ (aq) + 3 e- ⇌ A I (s) -1,66 Zn2+ (aq) + 2 e- ⇌ Zn (s) -0,76 Fe2+ (aq) + 2 e- ⇌ Fe (s) -0,44 Cu2+ (aq) + 2 e- ⇌ Cu (s) +0,34 Ag+ (aq) + e- ⇌ A g (s) +0,80
Com base na tabela, a afirmativa correta em relação ao processo de corrosão de metais é:
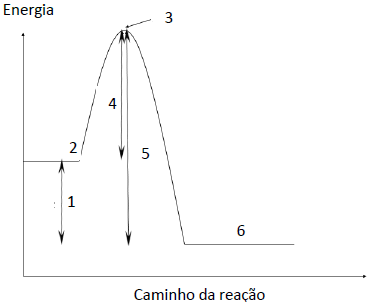
Energia de ativação, variação de entalpia da transformação e complexo ativado podem ser, respectivamente, associados aos números
Fonte: https://ucmp.berkeley.edu/glossary/gloss3/pigments.html (acessado em 02/05/2019).
As palavras que completam as lacunas, na ordem em que se encontram no texto, são:
I. No cátodo ocorre a formação de um gás.
II. No ânodo observa-se a liberação de um gás utilizado nas estações de tratamento de água.
III. O pH da solução resultante, após a eletrólise, é menor que 7.
Está/Estão correta(s) apenas a(s) afirmativa(s)
O fenômeno climático das monções, que ocorre na Ásia, propicia a dispersão de poluentes que formam particulados, como o sulfato de amônio [(NH4)2SO4]. Esse composto é formado na atmosfera pela reação da amônia (NH3) com o dióxido de enxofre (SO2), de acordo com as equações:
SO2 (g)+ 1/2O2(g) → SO3 (g)
H2O (ℓ)+SO3(g) → H2SO4 (ℓ)
2NH3 (g) + H2SO4 (ℓ) → (NH4)2SO4 (s)
Considere os valores de entalpia-padrão de formação:
SO2 (g) 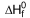 = -298 kJ/mol
= -298 kJ/mol
NH3 (g) 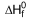 = -46 kJlmol
= -46 kJlmol
H2O (ℓ) 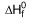 = -286 kJ/mol
= -286 kJ/mol
(NH4)2SO4 (s) 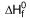 = -1179 kJ/mol
= -1179 kJ/mol
Com base nas informações apresentadas, pode-se afirmar
que a entalpia-padrão de reação de formação de 1 mol de
sulfato de amônio é
A chegada do homem à Lua, há 50 anos, possibilitou a coleta das rochas lunares, cuja análise permititu datar a idade do satélite natural da Terra com maior precisão. A técnica utilizada consistiu em determinar a proporção das quantidades do radioisótopo háfnio-182 e do isótopo estável tungstênio-182 presentes nessas rochas lunares.
O processo de decaimento radioativo do háfnio-182 apresenta uma etapa intermediária, na qual se forma o radioisótopo instável tântalo-182 que, por sua vez, decai para o tungstênio-182, de acordo com a equação:
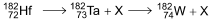
O decaimento radioativo do háfnio-182 resultando no tungstênio-182 em função do tempo ocorre de acordo com a curva apresentada no gráfico.
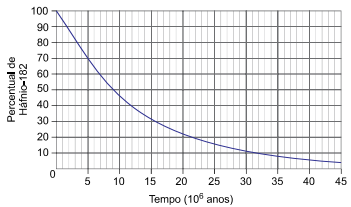
A emissão radioativa representada pela letra X na equação
de decaimento do háfnio-182 e a meia-vida desse radioisótopo em 106 anos são
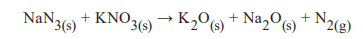

Ered(Ag+/Ag) = 0,80 v Ered(Cu2+/Cu) = 0,34 v
O cátodo, o ânodo e o valor de ∆E0 , respectivamente, da pilha são:
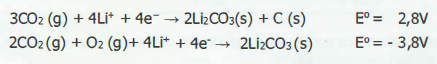
Sobre essas baterias, é correto afirmar que

