Questões de Vestibular
Comentadas sobre transformações químicas em química
Foram encontradas 249 questões
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Na < K < Ca < Cu < Sr < Ba.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
vezes, são negligenciadas. Entre elas, destaca-se o emprego de
revestimentos a base de poliuretano, um polímero altamente
inflamável que pode liberar, em sua combustão, gases tóxicos,
como o CO e o HCN.
Considerando o comportamento ideal para as soluções envolvidas,
julgue os itens subsequentes.
CaF2 (s) + H2SO4 (l) → CaSO4 (s) + 2 HF (g)
Considere que a massa molar do HF seja igual a 20 g· mol-1 e que a massa molar do CaF2 seja igual a 78 g· mol-1. Se 100 kg de ácido fluorídrico são obtidos a partir de 260 kg de fluorita impura, é correto afirmar que o teor percentual, em massa, de CaF2 nesse minério é
I – HCl(g) + NH 3(g) → NH4 Cl(s) (ácido clorídrico no estado gasoso reage com amônia no estado gasoso dando origem a cloreto de amônio no estado sólido).
II –CO2(g) + H2O(l) → H2 CO3(aq) (dióxido de carbono no estado gasoso reage com a água no estado líquido e dá origem a ácido carbônico em meio aquoso).
III – AgNO3(aq) + KI(aq) → Agl(s) + KNO3(aq) (solução aquosa de nitrato de prata reage com solução aquosa de iodeto de potássio formando iodeto de prata no estado sólido e nitrato de potássio insolúvel em água).
É correto APENAS o que se afirma em:
Se a massa de CO2 produzida foi 13,9 g, a quantidade em mol de CO é:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:
Sobre as características desse elemento e suas propriedades, em função da sua posição na tabela periódica, é correto afirmar que o iodo

Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.


Considerando essas informações, julgue os próximos itens.

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
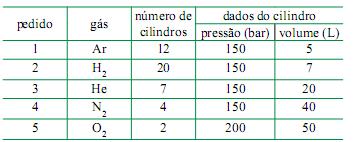
Sabendo que os cilindros rígidos e fechados estão armazenados na mesma condição de temperatura, o pedido que tem maior quantidade de matéria, em mol de gás, é o de número
I) X H2 + O2 → H2O
II) Ca(OH)2 + H3PO4 → H2O + A
III) Na + ZnCl2 → NaCl + Zn.
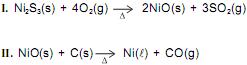
Um dos processos de obtenção do níquel, metal utilizado na fabricação de moedas, consiste, inicialmente, no aquecimento de sulfeto de níquel(III) na presença de ar. Durante esse processo, são formados óxido de níquel(II) e de dióxido de enxofre, de acordo com a equação química I, e, posteriormente, o NiO(s) reage com o carvão, em forno siderúrgico, com obtenção do níquel metálico e do monóxido de carbono, conforme reação representada na equação química II.
Considerando-se as informações do texto e as equações químicas I e II que representam, resumidamente, esse processo, é correto afirmar:
Considerando-se essas informações e as propriedades dos óxidos, é correto afirmar:


