Questões de Vestibular
Comentadas sobre transformações químicas em química
Foram encontradas 249 questões
Com relação à estrutura e às propriedades dos metais e seus íons, é correto afirmar:

Considerando-se que os cilindros I e II estão à temperatura de 27ºC e que os gases contidos no seu interior, respectivamente, CO2(g), N2(g) e He(g), se comportam como ideais, é correto afirmar:

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
Nos estados eletrônicos fundamentais, os elétrons dos íons K+ e Cl - ocupam o mesmo número de níveis de energia.
O átomo de potássio, por ser menor que o átomo de sódio (Na), apresenta a primeira energia de ionização maior que a do átomo de Na.
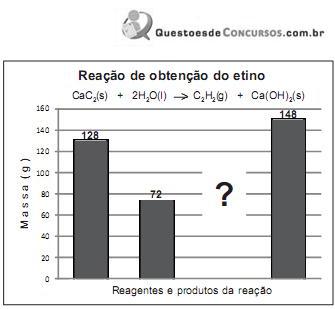
A massa, em gramas, de etino obtido nessa reação, que corresponde à coluna representada pelo ponto de interrogação, é
“No verão de 1774, Joseph Priestley, na Inglaterra, descobriu que quando se aquecia cal de mercúrio (óxido de mercúrio) ao rubro, dela desprendia um “ar” que, surpreendentemente, parecia ainda mais forte ou mais puro do que o ar comum. [...] Fascinado, Priestley investigou mais a fundo, descobrindo que camundongos podiam viver naquele ar ar por um tempo quatro vezes maior do que o ar comum. E assim, convencido de que aquele “novo” ar era benigno, ele próprio o experimentou.”
SACHS, Oliver. Tio Tungstênio. São Paulo: Companhia das Letras, 2002. P. 114.
O “novo ar” de que trata o texto é constituído essencialmente do elemento químico que
Se, em repouso, uma pessoa consome 0,34 L de oxigênio por minuto, então o aumento da temperatura do ar resultará em massa menor de oxigênio consumido por minuto pela pessoa, o que explica o fato de ser mais difícil se respirar em dias muito quentes.
Os compostos orgânicos gerados pela oxidação branda das duplas do ácido araquidônico usando-se uma solução aquosa diluída e neutra de KMnO4 — reação de Bayer — apresentam maior solubilidade em água que o ácido araquidônico.
Presente na hemoglobina, o íon divalente do ferro tem seu raio iônico maior que o raio do átomo do ferro metálico e apresenta distribuição eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d8 .
De acordo com o modelo de Thomson, o hidrogênio é constituído por 1 próton, 1 elétron e 1 nêutron.
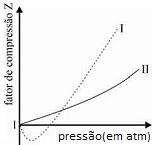
Considere que os gases da natureza, que são chamados de gases reais, tenham propriedades diferentes daquelas preditas pela lei dos gases ideais. Considere, ainda, o fator de compressão Z, que é a razão entre o volume molar do gás real e o volume molar de um gás ideal nas mesmas condições. Nesse caso, é correto afirmar que, no gráfico a seguir, da variação de Z em função da pressão, as curvas I e II representam, respectivamente, o comportamento dos gases NH3 e H2.
Sabe-se que o pH de alvejantes formados por soluções aquosas de hipoclorito de sódio é superior a 7. Isso se deve ao fato de o NaClO, ao reagir com a água, produzir o ácido hipocloroso (HClO), o que aumenta a razão [OH- ]/[H3O+ ] no meio.
Observe a foto, que mostra a grande diversidade fenotípica do ser humano.

Fonte: http://www.brasilescola.com/upload/e/diversidade%20cultural(1).jpg
Apesar das enormes diferenças entre os seres humanos, podemos afirmar que basicamente os elementos
químicos em maior porcentagem são sempre os mesmos. Quais são esses elementos químicos?
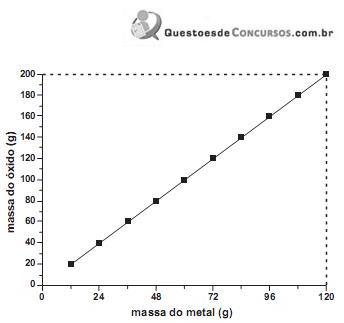
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
Um técnico de laboratório distraído preparou solições de carbonato de potássio (K2CO3),
hidróxido de sódio (NaOH) e de hidróxido de cálcio (Ca(OH)2), colocando- se em três frascos não rotulados ( frascos X, Y E Z ).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos,
amostras de cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos frascos X e Z, mas ocorreu uma efervenscência no
tuboque continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco ( frasco X, Y e Z ) em tubos de ensaios limpos.
Observou que só houve formação de precipitado quando misturou as soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.
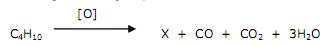
Daí pode-se afirmar que o composto X é um(a)
A ligação peptídica em um peptídio é:
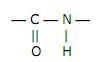
Com relação a ligação peptídica assinale a afirmação verdadeira.




