Umdeterminadometal queima ao ar para formar o respectivo óxi...
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
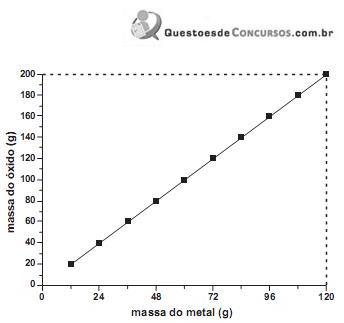
Pelo gráfico Metal + Oxigênio → Óxido
120g 80g 200 g
24g 16g 40 g
Primeiro experimento: Metal + Oxigênio → Óxido
24g 16g 40 g
1g x 1,4 g
↑
excesso
x = 16 ⋅ 1,4/40 = 0,56 g
Segundo experimento: Metal + Oxigênio → Óxido
24g 16g 40 g
1,5g 1,2g y
↑
excesso
y
= 1,5 ⋅ 40/24 = 2,5 g
Opção correta C.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo