Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
X + NaOH → R-CO2Na + R´-OH ,
qual é a espécie X e a classificação da reação?
O elemento químico X, comum às três ligas, latão (Zn + X), bronze (Sn + X) e ouro vermelho (Au + X), é isoeletrônico com Zn2+ quando seu próprio número de oxidação é igual a +1, e conserva sua alta condutibilidade elétrica e térmica ao compor as ligas. O elemento químico com as características citadas é
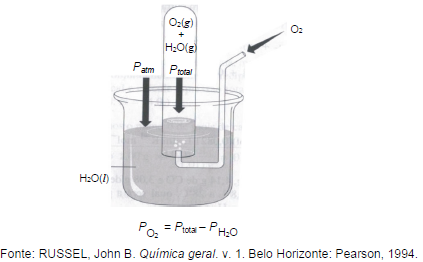
Supondo que nesse experimento 6,4 g de gás oxigênio (O2) é coletado sobre a água a 35ºC e a pressão total é de 0,980atm, o volume aproximado, em litros, que o gás irá ocupar é? Dados (pH2O = 0,056; R = 0,082)
Observação: elétron emparelhado.
O número atômico do átomo citado é:
Admitindo-se que a massa molar média do ar é 28,9 g/mol e com base nessas equações, é correto afirmar que
“A principal hipótese para o balão ter explodido e pegado fogo é que ele foi enchido com um gás impróprio para essa finalidade. O mais recomendado é o hélio, porque não pega fogo ou explode. Porém, pelo alto preço, algumas pessoas usam outros gases como butano [C4 H10] e hidrogênio [H2 ], o que pode causar vários acidentes”.
(Disponível em: http://g1.globo.com/goias/noticia/2016/05/mae-nao-pensava-quebalao-pudesse-explodir-e-queimar-filho-bomba.html. Acessado em 21/08/2016)
A notícia aponta dois gases como possíveis substitutos do gás hélio no balão flutuante que explodiu. O problema das possibilidades apontadas é que:

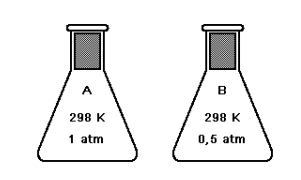
Sobre esses gases, são feitas as seguintes afirmações:
I. O frasco A apresenta o dobro de moléculas em relação ao frasco B. II. O número de átomos do frasco B é o dobro do número de átomos do frasco A. III. Ambos os frascos, A e B, apresentam a mesma massa. IV. Considerando que a reação ocorreu por completo, o frasco C ainda contém gás oxigênio.
São corretas as afirmações
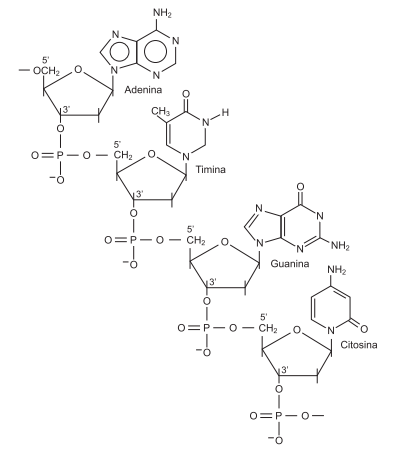
Existe vida de uma forma completamente diferente de tudo que se conhece até agora. A descoberta revelada pela Nasa é de uma bactéria que pertence ao grupo das halomonodáceas, que vive nas águas salgadas e ricas em arsênio do lago Mono, na Califórnia. A bactéria é uma forma de vida que incorpora no DNA, no lugar do fósforo, um elemento químico tóxico que não deveria fazer parte, em tese, da química da vida: o arsênio.
Uma análise dessas informações e da sequência de nucleotídeos do DNA, representada pela estrutura na figura, permite afirmar:
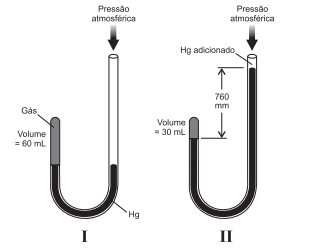
O químico inglês Robert Boyle investigou a relação entre a pressão de uma massa gasosa e seu volume à temperatura constante. Para atingir esse objetivo, realizou uma série de experiências utilizando um manômetro em forma de “jota” com uma extremidade aberta, como mostra a figura I e II. Boyle variou a pressão sobre o gás adicionando mercúrio dentro do tubo e, com os dados experimentais, estabeleceu uma relação empírica entre pressão e volume de uma massa gasosa.
Admitindo-se que o gás utilizado por Boyle é ideal, uma análise
dessas considerações permite afirmar:
Com base nessas considerações e comparando-se as propriedades dos elementos químicos rubídio e iodo, é correto afirmar:
O raio atômico é uma propriedade periódica cuja variação em função do número atômico é mostrada no gráfico abaixo.
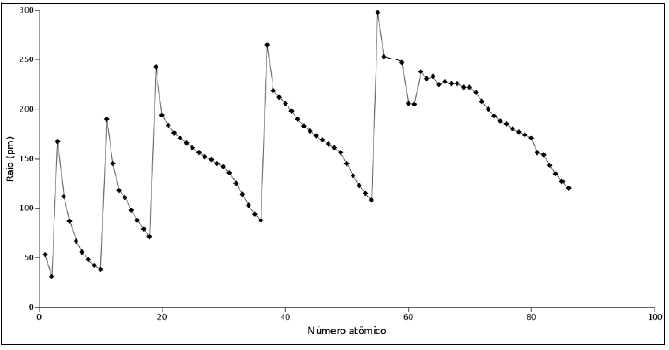
Nesse gráfico, os pontos máximos e mínimos representam, respectivamente:
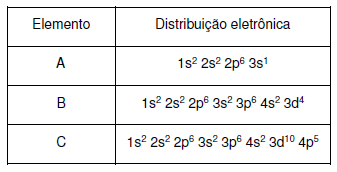
Considerando os dados da tabela e a classificação
periódica dos elementos, indique a afirmativa
incorreta.
