Questões de Vestibular de Química - Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador
Foram encontradas 59 questões
(CH3)3CBr(aq) + OH- (aq) → (CH3)3COH(aq) + Br- (aq)
Experimentos foram realizados para o estudo da cinética reacional, à temperatura constante de 60°C.
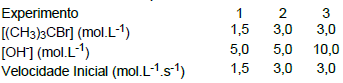
Baseado nos experimentos descritos acima, qual a lei de velocidade para a formação do terc-butanol?
No corpo humano, o álcool é removido da corrente sanguínea por uma série de reações metabólicas. A primeira reação produz etanal, de acordo com a equação química abaixo:
[O]
CH3CH2OH → CH3CHO
Foi realizado o acompanhamento da variação da concentração de etanol [C2H5OH] no sangue de um indivíduo alcoolizado para determinar a velocidade (v) pela qual o etanol é removido do sangue através das reações que ocorrem no organismo:
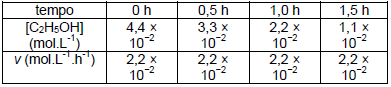
A partir dos dados fornecidos, assinale a alternativa
que contém os dados corretos para a equação da
velocidade da reação, o valor da constante de
velocidade e a ordem da reação.
 http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/Figuras/influ
encia/infl001.gif. Acesso em 12.fev.2019.
http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/Figuras/influ
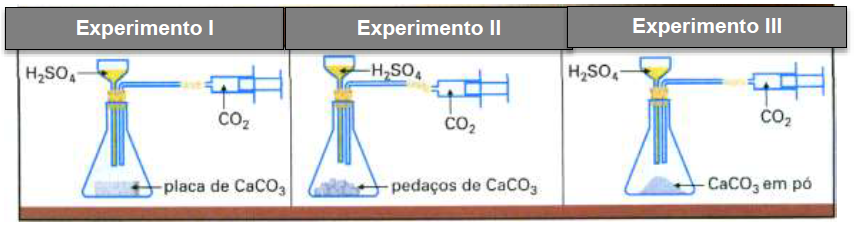
encia/infl001.gif. Acesso em 12.fev.2019. Os experimentos ilustrados utilizaram, nas três situações, quantidades iguais de massa de carbonato de cálcio e mesma concentração e volumes de ácido sulfúrico. Na seringa, foi coletado o gás carbônico como um dos produtos dessa reação.
A partir desses experimentos, deduz-se que, após reação total nos três casos,
De tempos em tempos, o mundo se choca com notícias sobre o uso de armas químicas em conflitos. O sarin é um composto organofosforado líquido, insípido, incolor e inodoro, altamente volátil, que se transforma em gás quando exposto ao ar, sendo um dos principais alvos dessas notícias. Em 1955, um projeto confidencial do exército americano estudou a eficiência de hipoclorito na eliminação de sarin em ambientes contaminados. A tabela a seguir mostra alguns resultados obtidos nesse estudo.
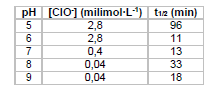
Sendo t1/2 o tempo para a concentração do sarin cair à
metade, de acordo com a tabela a reação é mais rápida em
Foi proposto a um grupo de alunos um experimento sobre a reação da casca de ovos com soluções de ácido clorídrico (HCl), usando os materiais e as condições descritas na tabela.
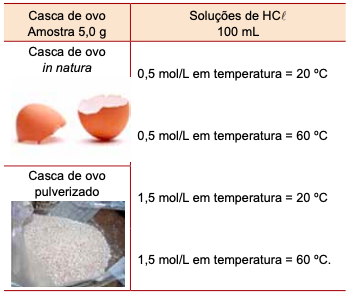
(http://www.saude.co/ e www.animalnatural.com.br. Adaptado)
O experimento consistia em medir o tempo da reação da solução ácida com a amostra de casca de ovo. Para a preparação do experimento, foi removida a película de material orgânico que compõe a casca de ovo, tanto para o seu uso in natura como para preparação da amostra em pó.
A combinação que apresentou o menor tempo de reação foi
aquela que usou
Foi realizada uma experiência, denominada de “Vulcão de Dicromato”, cujo procedimento foi o seguinte:
1. Adicionou-se uma porção de dicromato de amônio sólido em um erlenmeyer de capacidade de 2L, que foi tampado em seguida.
2. Colocou-se o erlenmeyer contendo a porção de dicromato de amônio sólido para aquecer sobre uma chapa aquecedora.
3. Observou-se que, no início do aquecimento, a cor laranja do dicromato se acentuou, ficando mais escuro, com formação de fagulhas luminosas e, em seguida, ocorreram mudança de coloração do sólido para verde e saída intensa de luz, caracterizando a decomposição, por calor, do dicromato de amônio.
Com relação a essa experiência, é correto dizer que
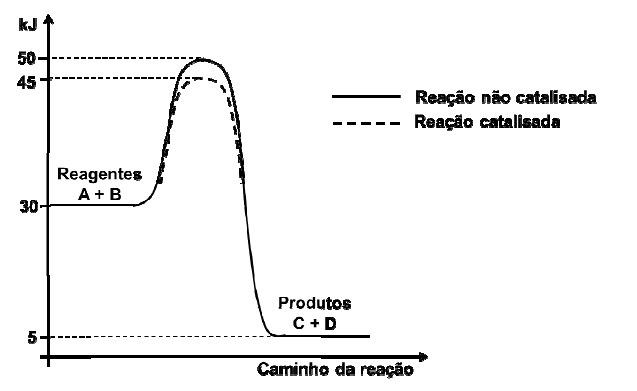
Sobre a reação, podemos afirmar que:
Uma representação adequada para esse processo é:
Um antiácido comercial em pastilhas possui, em sua composição, entre outras substâncias, bicarbonato de sódio, carbonato de sódio e ácido cítrico. Ao ser colocada em água, a pastilha dissolve‐se completamente e libera gás carbônico, o que causa a efervescência. Para entender a influência de alguns fatoressobre a velocidade de dissolução da pastilha, adicionou‐ se uma pastilha a cada um dos quatro recipientes descritos na tabela, medindo‐se o tempo até a sua dissolução completa.
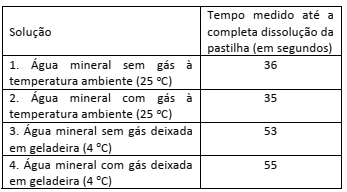
Para todos os experimentos, foi usada água mineral da mesma marca. Considere a água com gás como tendo gás carbônico dissolvido.
Com base nessas informações, é correto afirmar que
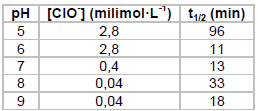
Sendo t1/2 o tempo para a concentração do sarin cair à metade, de acordo com a tabela a reação é mais rápida em
Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
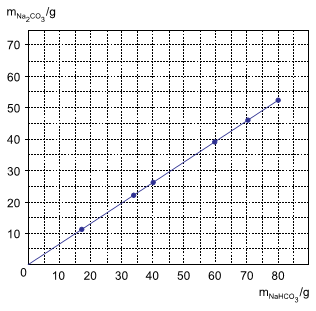
Os dados do gráfico permitem concluir que as massas de
carbonato de sódio e bicarbonato de sódio nessa reação
estão relacionadas pela equação 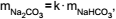 e
que o valor aproximado de k é
e
que o valor aproximado de k é
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
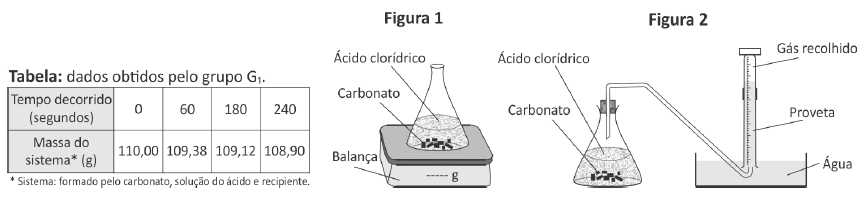
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
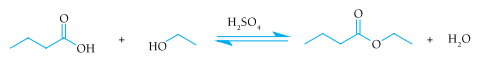
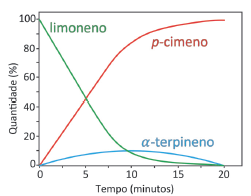
As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico:
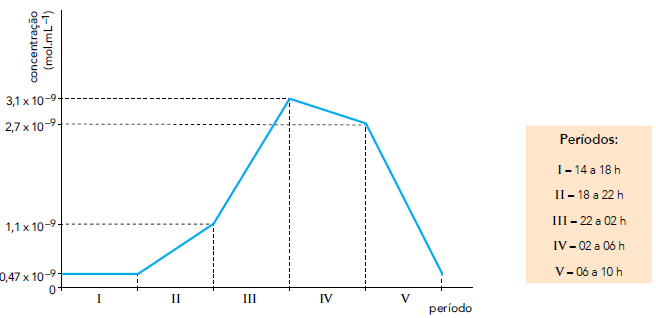 A maior taxa de produção do hormônio, em mol.mL–1.h–1, verificada em um dos cinco períodos
do exame, corresponde a:
A maior taxa de produção do hormônio, em mol.mL–1.h–1, verificada em um dos cinco períodos
do exame, corresponde a:
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo(luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reaçãobioquímica é gerado um produto em um estado eletronicamenteexcitado (oxiluciferina*). Este produto, por suavez, desativa-se por meio da emissão de luz visível, formandoo produto no estado normal ou fundamental (oxiluciferina).Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bio-luminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados,responsáveis pela emissão de luz na cor verde ou na cor vermelha.

O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
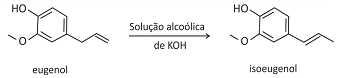
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
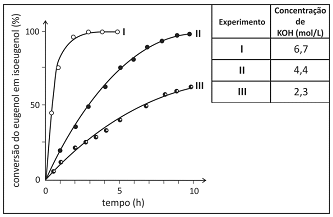
Analisando-se o gráfico, pode-se concluir corretamente que
2 NaHCO3 (s) → Na2CO3 (s) + H 2O (g) + CO2 (g)
Considere o preparo de dois bolos com as mesmas quantidades de ingredientes e sob as mesmas condições, diferindo apenas na temperatura do forno: um foi cozido a 160 oC e o outro a 220 oC. Em ambos, todo o fermento foi consumido.
O gráfico que relaciona a massa de CO2 formada em função do tempo de cozimento, em cada uma dessas temperaturas de preparo, está apresentado em:
HBr(g) + NO2(g) → HBrO(g) + NO(g) (lenta) HBr(g) + HBrO(g) → Br2(g) + H2O(g) (rápida)
A partir do mecanismo proposto, é correto afirmar:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:
