Questões de Vestibular
Comentadas sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 58 questões
As empresas farmacêuticas utilizam diferentes tecnologias para permitir a liberação controlada. Em alguns casos, por exemplo, o medicamento possui um revestimento que se dissolve depois de um período para liberar as partículas de fármaco. O revestimento tem por objetivo controlar a velocidade da reação e liberar uniformemente o fármaco no organismo.
Considerando o texto apresentado, assinale V (verdadeiro) ou F (falso) para as afirmações a seguir.
( ) Um fármaco constituído de partículas menores é absorvido mais lentamente pelo organismo do que outro com partículas maiores. ( ) A área superficial em um medicamento sólido na forma de pó é maior do que a área superficial em um medicamento na forma de comprimido. ( ) Quanto maior a espessura do revestimento do fármaco, maior o tempo para o fármaco ser absorvido pelo organismo.
O correto preenchimento dos parênteses, de cima para baixo, é
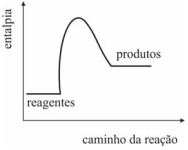
O gráfico a seguir representa corretamente a reação de combustão da madeira usada na queima da argila para a formação da cerâmica.
As reações de hidrólise de ésteres, quando realizadas em meio aquoso, podem ser catalisadas pela adição de ácido, sendo a reação mais lenta em meios próximos da neutralidade.
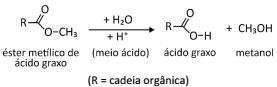
Duas reações idênticas para a hidrólise desse éster foram
realizadas nas mesmas condições, variando apenas o pH do
meio: uma delas foi conduzida em pH=2 e outra em pH=6. Qual
dos seguintes diagramas representa de forma mais adequada a
quantidade de ácido graxo formada em função do tempo de
reação para as hidrólises em pH=2 e pH=6?
CO(g) + NO2 (g) ➔ CO2 (g) + NO(g)
A reação teve sua cinética estudada e os dados obtidos em alguns experimentos estão indicados na tabela abaixo
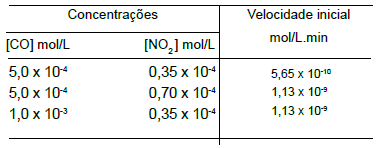
Em relação ao que foi descrito, é correto concluir que a reação apresenta
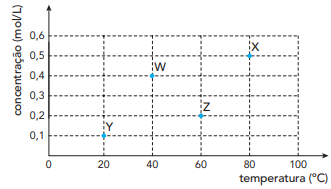
A maior velocidade inicial de formação de gás hidrogênio foi verificada no seguinte experimento:
A reação de decomposição do ozônio é representada pela equação a seguir:
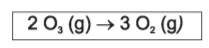
Num dado experimento de decomposição do ozônio, observou-se a variação da concentração molar de O3 em função do tempo, demonstrada no quadro abaixo.

Analisando os dados experimentais, a velocidade
média de produção de gás oxigênio (O2), em
mol/L.minuto, nos 3 minutos iniciais da reação é:
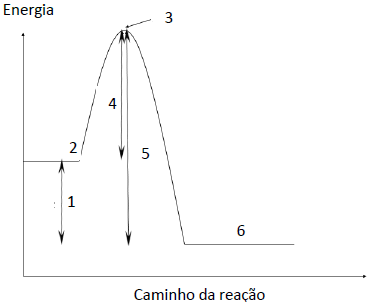
Energia de ativação, variação de entalpia da transformação e complexo ativado podem ser, respectivamente, associados aos números
I. A velocidade de uma reação é uma grandeza que indica como as quantidades de reagentes e produtos dessa reação variam em uma escala temporal. II. A velocidade das reações química depende da concentração dos reagentes. III. Quanto maior for a concentração de reagentes, menor será a velocidade das reações químicas. IV. Em uma reação química, a energia de ativação corresponde ao valor mínimo de energia que as moléculas de reagentes devem possuir para que seja eficaz uma colisão entre elas. V. O valor específico da energia de ativação em uma reação química é uma constante comum a todos os tipos de reações que podem ocorrer. VI. O aumento da temperatura, em uma reação química, contribui para o aumento da velocidade desta reação. VII. Uma substância caracterizada como catalisadora, aumenta a velocidade de uma reação química e, portanto, será, sem exceções, consumida durante a reação. VIII. Um catalisador aumenta a velocidade de uma reação química, pois promove aumento da energia de ativação da mesma. IX. Em uma reação química, a alteração na velocidade devido à ação de um catalisador é denominado catálise.
Na correção dessas afirmações feitas pelo aluno na prova, o professor descontou 2 pontos por cada afirmação incorreta. Sendo assim, pode-se considerar que foi descontado na prova do referido aluno:
Numa determinada condição experimental e com o catalisador adequado, ocorre uma reação, conforme representada no gráfico, que relaciona porcentagem do composto pelo tempo de reação.
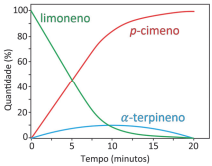
Uma representação adequada para esse processo é:
Com relação a princípios da química, julgue o próximo item.
Situação hipotética: Durante um experimento, um refrigerante, a uma temperatura T1, foi colocado em um copo; em seguida, outro refrigerante (de marca mesma), a uma temperatura T2, foi colocado em outro copo. Formaram-se bolhas em ambos os refrigerantes assim que estes foram despejados nos copos, mas a quantidade de bolhas formadas no refrigerante sob a temperatura T1 foi menor que a quantidade de bolhas formadas no refrigerante sob a temperatura T2. Assertiva: Nessa situação, depreende-se que T1 é maior que T2.
A química explica o fato de que reações de decomposição alimentos são retardadas quando eles ficam armazenados em geladeiras.
Analise o esquema.
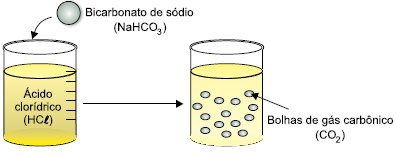
Admita que a reação ocorrida seja instantânea.
Se a velocidade de consumo do bicarbonato de sódio foi
2,5 × 10–3
mol/L × s, a velocidade de formação do gás carbônico foi de
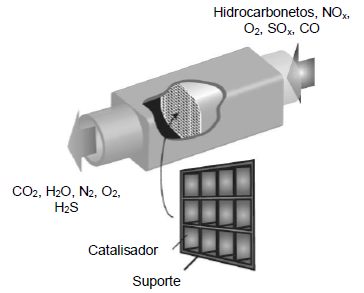
Figura adaptada de Duward Shriver et al., Inorganic Chemistry, 6 ed., 2014.
Sobre o processo de catálise ilustrado acima, é correto afirmar o que segue
(CH3)3CBr(aq) + OH- (aq) → (CH3)3COH(aq) + Br- (aq)
Experimentos foram realizados para o estudo da cinética reacional, à temperatura constante de 60°C.
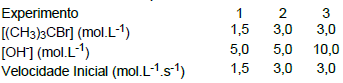
Baseado nos experimentos descritos acima, qual a lei de velocidade para a formação do terc-butanol?
 http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/Figuras/influ
encia/infl001.gif. Acesso em 12.fev.2019.
http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/Figuras/influ
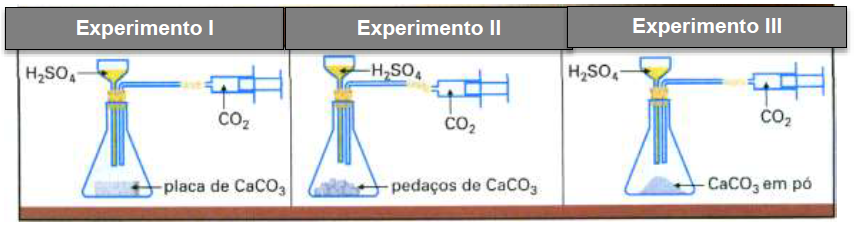
encia/infl001.gif. Acesso em 12.fev.2019. Os experimentos ilustrados utilizaram, nas três situações, quantidades iguais de massa de carbonato de cálcio e mesma concentração e volumes de ácido sulfúrico. Na seringa, foi coletado o gás carbônico como um dos produtos dessa reação.
A partir desses experimentos, deduz-se que, após reação total nos três casos,
Foi realizada uma experiência, denominada de “Vulcão de Dicromato”, cujo procedimento foi o seguinte:
1. Adicionou-se uma porção de dicromato de amônio sólido em um erlenmeyer de capacidade de 2L, que foi tampado em seguida.
2. Colocou-se o erlenmeyer contendo a porção de dicromato de amônio sólido para aquecer sobre uma chapa aquecedora.
3. Observou-se que, no início do aquecimento, a cor laranja do dicromato se acentuou, ficando mais escuro, com formação de fagulhas luminosas e, em seguida, ocorreram mudança de coloração do sólido para verde e saída intensa de luz, caracterizando a decomposição, por calor, do dicromato de amônio.
Com relação a essa experiência, é correto dizer que
R1(g) + R2(g) → P(g)
Três experimentos foram feitos, em temperatura constante, e seus dados coletados e organizados na Tabela abaixo.
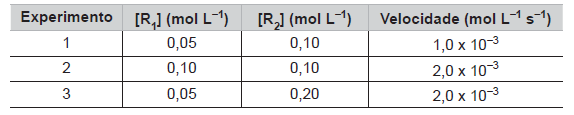
Considerando os resultados dos experimentos, está correto afirmar que a expressão da velocidade (v) dessa reação, onde k é uma constante, é
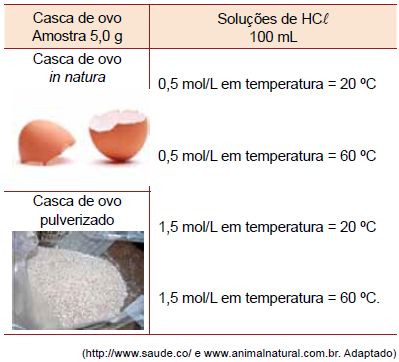
O experimento consistia em medir o tempo da reação da solução ácida com a amostra de casca de ovo. Para a preparação do experimento, foi removida a película de material orgânico que compõe a casca de ovo, tanto para o seu uso in natura como para preparação da amostra em pó.
A combinação que apresentou o menor tempo de reação foi aquela que usou
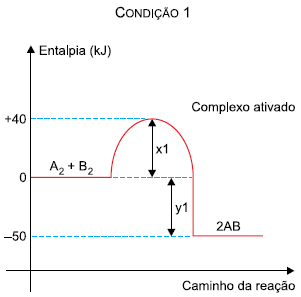
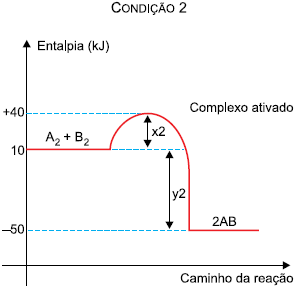
Na comparação entre as duas condições, verifica-se que:
